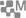Le cycle des Colloques “Chimie &…” s'enrichit d'un nouvel opus :
Chimie et Notre-Dame : La science au service d'une résurrection
Mercredi 9 février 2022
Maison de la Chimie, 28 bis rue Saint-Dominique, 75007 Paris
Après l’incendie de Notre-Dame de Paris qui, en 2019, nous a tous bouleversés, le Ministère de la Culture et le CNRS se sont mobilisés au côté de l’Établissement public chargé de la conservation et de la restauration de la cathédrale Notre-Dame de Paris créé par l’État et se sont associés dans le cadre d’un grand chantier scientifique pour mettre les compétences et les connaissances des chercheurs d’une cinquantaine de leurs laboratoires au service de la « résurrection » de l’édifice et de ses œuvres d’art. À cette occasion, ces chercheurs se sont aussi donné pour objectif le renouvellement des connaissances sur l’édifice et son histoire.
La chimie est présente aussi bien sur le chantier de restauration que dans ce programme de recherche et d’innovation qui associe archéologues, historiens de l’art, chimistes, physiciens et informaticiens, aux architectes et compagnons présents sur le site.
La Fondation de la Maison de la Chimie a souhaité faire le point sur ce que les sciences de la chimie ont et pourront apporter dans le programme de restauration de la cathé-drale et plus généralement via des innovations dans le domaine des matériaux du patrimoine. Le responsable et les coordinateurs du programme nous ont fait l’honneur non seulement d’intervenir comme conférenciers, mais aussi de nous aider dans le choix des experts pour réaliser cet ambitieux objectif. Nous les en remercions vivement. La vue de l’incendie de Notre-Dame de Paris et son triste bilan ont profondément touché les citoyen de tous âges dans le monde entier.
Ce colloque, qui vise à apporter des informations précises sur le rôle possible des sciences « chimiques » dans la réparation de ce terrible événement et comment la chimie peut contribuer à lui redonner vie, est ouvert à tous les publics, avec une attention particulière aux jeunes et au monde éducatif. Le niveau des interventions se veut accessible à tous.
Bernard Bigot
Président de la Fondation internationale de la Maison de la Chimie
et Directeur Général de l’Organisation internationale ITER
Aller vers la page : Diffusion en direct
Information :
L’accès au colloque est gratuit mais pour participer, l’inscription est obligatoire et se fait uniquement en ligne.
Nous vous informons que pour entrer dans la Maison de la Chimie, vous devrez être en possession d’un Pass Sanitaire ou d’un justificatif de Test antigénique/PCR de moins de 24 heures.
Par ailleurs, le port du masque sera obligatoire dans toute l’enceinte de la Maison de la Chimie.
Le colloque sera également retransmis en direct tout au long de la journée sur la chaîne YouTube de notre médiathèque mediachimie.org pour permettre la participation du plus grand nombre.
La fenêtre qui donnera accès au streaming ne sera ouverte que le jour du colloque.
SI VOUS SOUHAITEZ SUIVRE LE COLLOQUE A DISTANCE, MERCI DE NE PAS VOUS INSCRIRE.
Le déjeuner, compris dans l’inscription, est gratuit mais sous réserve des places disponibles (même si réservé lors de l’inscription), les scolaires étant prioritaires.
Les enseignants souhaitant venir au colloque accompagnés de leur classe sont priés de bien vouloir contacter le secrétariat des inscriptions : p.bridou-buffet@maisondelachimie.com.
Intervenants :
- Bernard BIGOT, Président de la Fondation internationale de la Maison de la Chimie et Antoine PETIT, Président-Directeur Général du CNRS — Introduction
- Sophie AYRAULT, Directrice de Recherches au CEA, Laboratoire des Sciences du Climat et de l'Environnement (LSCE), Université Paris Saclay — Tracer les plombs de Notre-Dame de Paris par leur signature isotopique et élémentaire.
- Richard BOYER, Directeur Général SOCRA — La restauration des statues en cuivre de la flèche de la cathédrale Notre-Dame de Paris.
- Livio de LUCA - Directeur de l'UMR Modèles et simulations pour l’Architecture et le Patrimoine (MAP), Directeur de recherche au CNRS — Un écosystème numérique pour l’analyse et la mémorisation multidimensionnelle du chantier scientifique Notre-Dame.
- Philippe DILLMANN, Directeur de Recherche - CNRS — Matériaux du patrimoine, compréhension du passé, prévision du futur ; quelques exemples.
- Alexa DUFRAISSE, Chargée de recherche au CNRS, UMR 7209 Archéozologie, archéobotanique : Sociétés, Pratiques et Environnements (ASSPE), CNRS/MNHN, Paris — Mémoire du bois : apport de la chimie à la connaissance de la charpente carbonisée de Notre-Dame de Paris.
- Rémi FROMONT, ACMH - Covalence Architectes et Pascal PRUNET, Architecte en chef des Monuments Historiques — Notre-Dame de Paris, matériaux et construction.
- Général d’armée Jean-Louis GEORGELIN | représentant spécial du Président de la République et président de l’établissement public chargé de la conservation et de la restauration de la cathédrale Notre-Dame de Paris — Le chantier de Notre-Dame de Paris : état et perspectives
- Julien Le BRAS, Président Directeur Général Groupe Le Bras Frère — Charpente de sécurisation des arcs boutants et des voûtes.
- Maxime L’HERITIER, Maître de conférences en histoire médiévale, Université Paris 8, ArScAn CNRS UMR 7041 — L'apport des analyses chimiques à la connaissance des armatures de fer de Notre-Dame de Paris.
- Pascal LIEVAUX - Conservateur général du patrimoine, délégation à l'inspection, à la recherche et à l'innovation, direction générale des Patrimoines et de l'Architecture et Aline MAGNIEN - Conservatrice générale du patrimoine, Directrice du Laboratoire de Recherche des Monuments historiques, Ministère de la Culture et de la Communication — De la chimie des matériaux à l’alchimie des équipes.
- Claudine LOISEL, Ingénieure de recherche, responsable du pôle scientifique Vitrail, Laboratoire de recherche des monuments historiques (LRMH) — La conservation-restauration et la recherche sur les vitraux de la cathédrale Notre-Dame de Paris.
- Witold NOWIK, Chimiste, Ingénieur de recherche, responsable du pôle Peinture murale et polychromie, Laboratoire de Recherche des Monuments Historiques. et Marie PARANT, Restauratrice de peintures murales, indépendante — Conservation-restauration de peintures polluées par dépôt d’aérosols de plomb.
- Véronique VERGES-BELMIN, Géologue, Ingénieure de recherche, responsable du pôle scientifique Pierre, Laboratoire de recherche des monuments historiques (LRMH) — Conservation des maçonneries endommagées par les sels solubles suite à l'incendie de Notre-Dame de Paris en 2019.
Conception graphique : CB Defretin | Images : © Renato SALERI / MAP / Chantier Scientifique Notre-Dame de Paris / Ministère de la culture / CNRS – © Cyril FRESILLON / IRAMAT / NIMBE / ArScAn / CEA / Chantier Scientifique Notre-Dame de Paris / Ministère de la culture / CNRS – © V. ABERGEL/A. GROS/MAP/MIS/Vassar College/A-BIME/Chantier Scientifique Notre-Dame de Paris/Ministère de la culture/CNRS – © V. ABERGEL/L. DE LUCA/MAP/SRA-DRAC/AGP/MIS/Chantier Scientifique Notre-Dame de Paris/Ministère de la culture/CNRS – © Cyril FRESILLON / AASPE / CNRS Photothèque – © Kévin JACQUOT / MAP / Chantier Scientifique Notre-Dame de Paris / Ministère de la culture / CNRS – © V. ABERGEL/L. DE LUCA/MAP/SRA-DRAC/AGP/Vassar College/MIS/Chantier Scientifique Notre-Dame de Paris/Ministère de la culture/CNRS
L’expression « hydrogène à faible empreinte carbone » est plutôt recommandée par le Journal officiel. L’hydrogène jouera sans doute un rôle important dans la transition énergétique. Il possède en effet l’énergie massique la plus élevée des combustibles (1200 MJ/kg) soit trois fois celle de l’essence ; de plus son utilisation dans les piles à combustible avec l’oxygène ne forme en effet que de l’eau sans aucune émission de produits polluants et fait l’objet de nombreux articles et dossiers dans la presse. Il est aussi à ce jour le meilleur moyen de stocker massivement de l’énergie sur une longue durée ce qui permet de répondre à l’intermittence des énergies solaire et éolienne.
Acccéder au Zoom sur les derniers résultats de la production d’hydrogène « décarboné »
Les fêtes arrivent et vous allez peut-être nonchalamment poser votre verre de vin, de champagne ou de Coca-Cola® sur le plateau de marbre qui recouvre un ancien meuble chez vos parents ou grands-parents.
Aïe aïe aïe ! Un anneau rugueux et parfois blanchâtre risque d’apparaitre quand vous allez retirer votre verre si quelques gouttes du précieux liquide ont coulé le long du verre jusqu’à son pied. Mais que s’est-il passé ?
Des boissons légèrement acides
Les vins qu’ils soient blancs ou rouges sont légèrement acides. En effet ils contiennent entre autres les acides tartrique, malique, citrique, lactique et succinique. Les trois premiers proviennent du moût et les deux derniers des fermentations. Le pH est la grandeur qui mesure cette acidité (i). En moyenne il vaut environ 3,3 pour un vin blanc, 3,5 pour un rouge, 3,4 pour un rosé et 3,0 pour un champagne. Quant au Coca-Cola® qui contient de l’acide phosphorique, son pH est voisin de 2,5 pour le classique (ii). De même les jus de fruits comme les jus d’orange ou de citron sont acides. Les boissons gazeuses contiennent de plus une forte concentration en dioxyde de carbone CO2.
Et le marbre, de quoi est-il fait ?
Nous parlons ici du vrai marbre. Le calcaire ou carbonate de calcium (CaCO3) est le principal constituant des marbres. S’ils sont colorés, veinés, ou polychromes comme peut être celui du plateau de votre meuble c’est grâce à la présence d’autres éléments chimiques (iii). Selon les carrières d’où provient le marbre ces éléments sont caractéristiques et font sa renommée, comme le marbre blanc veiné de gris de Carrare ou le rose des carrières de Caunes-Minervois que l’on peut admirer au Grand Trianon dans le parc du château de Versailles…
Quelles réactions avec le marbre ? Il faut distinguer les boissons tranquilles des boissons gazeuses.
Pour les vins et jus de fruits non gazeux
Le calcaire est une base et si un acide l’attaque, il se passe une réaction qui s’accompagne d’un dégagement de dioxyde de carbone. Cela dégrade le calcaire en surface. Appelons RCOOH tout acide présent et la réaction s’écrit :
2 RCOOH + CaCO3 → 2 RCOO- + Ca2+ + CO2 (gaz°) + H2O
Quand vous retirez votre verre, un petit rond creux apparait et la surface du marbre y est devenue un peu rugueuse. La dégradation locale est irréversible. Pour redonner un bel aspect il faudrait repolir le marbre.
Pour le champagne et les boissons au cola, c’est plus compliqué !
Ces deux boissons présentent de plus du dioxyde de carbone dissous. Pour le champagne il s’est formé in situ lors de la fermentation alcoolique en milieu clos (iv). Pour le cola il est ajouté sous pression. À la réaction acido-basique précédente se superposent d’une part une attaque par l’acide phosphorique dans le cas du cola et pour les deux une suite de réactions liées à la forte présence de CO2 dissous.
CaCO3 (contenu dans le marbre) + CO2 (dans la boisson) + H2O → 2 HCO3- + Ca2+
Des ions bicarbonate (HCO3-) (v) et des ions calcium (Ca2+) sont dissous dans l’eau de la boisson et présents à la surface du marbre. Si on laisse s’évaporer l’eau il se forme un dépôt complémentaire. Du carbonate de calcium blanc se reforme avec dégagement de CO2 selon :
2 HCO3- + Ca2+ → CaCO3(s) (dépôt à la surface du marbre) + CO2 + H2O
Mais les conditions de cristallisation de ce carbonate ne sont plus les mêmes que celles géologiques qui ont conduit aux cristaux de calcite du marbre. La trace blanche qui apparait est ainsi du calcaire pulvérulent déposé sur le marbre !
C’est pourquoi il est déconseillé de réaliser un plan de travail en vrai marbre dans une cuisine car le risque de déposer un liquide (vinaigre, vin…) ou un aliment acide (citron, agrume…) est très important. Les plans de travail d’aspect pierre et résistants sont plutôt en granit ou en matériaux de synthèse capable de parfaitement imiter le marbre ! Il existe aussi des « plans de travail mélaminés » : sur le support en bois aggloméré on encolle une feuille décorative imitant le marbre blanc veiné ou de carrare et enduite d'une couche de résine mélamine (vi) polymère thermodurcissable très résistant.
Toutefois des plans de travail en marbre pour cuisine ou coin repas existent et sont traités en surface par imprégnation afin de boucher les pores et laisser en surface une couche hydrophobe à base de silicones. Il est nécessaire de les entretenir, les nourrir et les protéger par des produits adaptés (cire translucide…).
Certains lavabos ou vasques de salle de bain sont en vrai marbre. Le risque est plus faible d’y renverser un liquide acide, mais pensez-y !
Françoise Brénon et l’équipe Question du mois
(i) Le pH dans l’eau varie de 0 à 14. Le milieu est neutre quand le pH vaut 7. Il est acide si pH < 7 et basique si pH > 7.

(ii) À combien s'élève le pH du Coca‑Cola et qu'est-ce que cela veut dire? sur le site Coca-Cola Suisse
(iii) Le calcaire y est présent sous forme de cristaux de calcite, CaCO3, pouvant présenter des structures différentes avec des traces d’autres ions minéraux (manganèse Mn, fer Fe, zinc Zn…).
(iv) Ce sont presque 5 litres de CO2 qui sont piégés dans une bouteille standard créant une pression d’environ 5 à 6 bar. Attention donc de ne pas prendre le bouchon dans les yeux quand il saute ! Pour en savoir plus : Pourquoi y-a-t-il des bulles dans mon champagne ?
(v) L’ion HCO3- a pour nom hydrogénocarbonate mais il est plus connu dans le grand public sous le nom de bicarbonate.
(vi) Le monomère mélamine a pour formule C3H6N6

Pour en savoir plus
Carbonate de calcium / calcite/ calcaire, Produit du jour de la SCF
Zoom sur la vinification, Mediachimie.org
Mesurer le pH d’une solution : des acides, du raisin au vin, dossier Nathan Mediachimie, Mediachimie.org
Crédits illlustration : Tache sur marbre. Source : Françoise Brénon
Le colloque " Chimie et agriculture durable: un partenariat en constante évolution scientifique " a eu lieu le 10 novembre 2021. Retrouvez dès maintenant les captations vidéos des conférences du colloque sur Youtube/mediachimie ou sur le site de la Fondation de la Maison de la chimie.
Alors que la stratégie gouvernementale de la transition énergétique se base en partie sur l’énergie éolienne, nombre d’experts pointent la difficulté d’atteindre les objectifs fixés pour 2028. En effet il existe en France en 2021 8000 éoliennes sur 1400 parcs, qui ont fourni 8% de la production électrique en 2020 pour une puissance installée de 18 GW (1). Les objectifs de la feuille de route sont d’arriver à 34 GW pour l’éolien terrestre soit donc de doubler le nombre d’éoliennes, et de 5 GW pour l’offshore. Les puissances individuelles de chaque éolienne sont passées en plus de 20 ans de 1,5 MW à 5 MW voire 7 MW pour l’éolien en mer. Comme la puissance est proportionnelle à la surface du cercle décrit par les pales, celles-ci sont passées de 20 m à près de 160 m de longueur grâce au progrès de la chimie des matériaux composites (2).
Une note du ministère de la Transition écologique rappelle que pour atteindre les objectifs il sera nécessaire de s’assurer de la rentabilité des installations, de leur maintenance, de leur intégration paysagiste et enfin de leur recyclage. Au moment où de plus en plus de Français s’inquiètent ou s’opposent à de nouveaux champs terrestres d’éoliennes et les pêcheurs aux implantations en mer, il importe de se pencher sur le démontage et recyclage des installations (3).
La durée de vie d’une éolienne est de 20 à 30 ans et c’est depuis les années 80 à 90 que l’implantation des parcs s’est faite en Europe. Après plus de 20 ans de bons et loyaux services les machines peuvent être démantelées ou remplacées par d’autres plus modernes. On estime en France à 1500 le nombre d’installations à démonter d’ici 2025 et la PPE (Programmation Pluriannuelle de l’Énergie) précise que le recyclage des principaux composants sera obligatoire dès 2023. En fait près de 75 à 80% de la masse de l’installation peut être recyclée, le béton du socle et l’acier des mâts, la cellule et même le cuivre et les terres rares du rotor sont valorisables. Sur le site lui-même, les excavations des fondations, la remise en état du terrain sont prévues dans la convention privée.
Mais que faire des pales ?
Les premières générations d’éoliennes arrivent en fin de vie et le président de WindEurope estime que d’ici 2023 14000 pales d’éoliennes seront mises hors service et leur recyclage devient une priorité absolue. Ce n’est pas facile car elles sont constituées de matériaux composites comportant des fibres de verre ou plus récemment de fibres de carbone assemblées avec des résines époxy ou de polyester (4). Et jusqu’à présent notamment aux États-Unis elles terminent en enfouissement.
Plusieurs voies sont explorées :
Mécaniques, pour les pales renforcées en fibres de verre
- le broyage : la pale est découpée en morceau puis dans un broyeur à couteau transformée en poudre ou granulés et brulés en cimenterie par exemple ou enfouis.
- les fibres de verre courtes peuvent être utilisées comme renfort dans le béton dans le mobilier urbain ou enrobés routiers. Mais une fois séparées les fibres perdent une partie de leurs propriétés mécaniques.
Chimiques, pour les pales renforcées en fibres de carbone
La fibre de carbone (5) change les données économiques, car bien que de plus en plus utilisée elle reste cependant coûteuse et sa récupération même complexe a un coût élevé. Cela justifie une opération de recyclage. On peut alors trouver plusieurs procédés :
- la solvolyse à haute pression et à 200°-300°c par l’eau supercritique (6), celle-ci devient un solvant qui dissous les composés organiques comme les résines thermodurcissables des pales et permet de séparer les fibres de carbone de la matrice qui peuvent être récupérées.
- la pyrolyse entre 400° et 700°C en milieu semi confiné on « distille » la résine en oléfines, huiles et goudrons et on récupère la fibre de carbone qui n’a pas été oxydée.
- l’écoconception par l’utilisation d’une résine thermoplastique de type polyacrylate comme Elium℗ d’Arkema (7). Lors de la fabrication de la pale la résine liquide est déposée dans le moule sur les tissus et fibres de carbone, on y ajoute le catalyseur de polymérisation qui se fait à température ambiante et en quelques dizaines de minutes. L’avantage est d’utiliser les mêmes outils de conception que pour le thermodurcissable mais sans dépense d’énergie et la réparabilité à froid en cas de dommage est assurée. En fin de vie deux solutions : un procédé de broyage et d’ajouts aux granulés de polymères compatibles comme le PMMA ou l’ABS mené par la plateforme Canoe et l’ICMCB conduit à des nouveaux objets composites ; seconde solution, par chauffage des fragments du composite broyé, on peut aussi dépolymériser le thermoplastique et récupérer le monomère séparé des fibres, des colles et peintures (8).
Si d’ici 2030 on estime à plus de 35000 tonnes de pales issues du démantèlement en Europe et en France à un flux de 1500 t en 2029 nous avons en innovation chimique du pain sur la planche ! D’autant qu’il n’y a pas encore de vraies filières d’économie circulaire (9) pour les matériaux composites non seulement pour les pales d’éoliennes mais aussi pour l’industrie nautique - les coques de bateaux -, aérienne - les corps des avions - et automobile où ils envahissent le marché.
Jean-Claude Bernier
Novembre 2021
Pour en savoir plus
(1) Les énergies renouvelables (vidéo du CEA série « Les Incollables »)
(2) Les chimistes dans l’aventure des nouveaux matériaux (série Les chimistes dans…, mediachimie.org)
(3) Vitesse de déploiement et acceptabilité des nouvelles technologies dans le domaine des énergies, Grégory De Temmerman, Colloque Chimie et énergies nouvelles (février 2021)
(4) Matériaux composites à matrice polymères, d'après la conférence de Patrice Hamelin, La chimie et l’habitat, EDP Sciences (2011)
(5) Les matériaux dans le sport (r)évolutionnaires ! Patrice Bray, Odile Garreau et Jean-Claude Bernier (série Chimie et … en fiches, Médiachimie.org), d’après l’article de Y. Rémond et J.-F . Caron, in La chimie et le sport, EDP Sciences (2011)
(6) Les fluides supercritiques à votre service, S. Sarrade et K. Benaissi, L'Actualité Chimique n°371-372 (2013) p. 72
(7) Les matériaux de la transition énergétique : les attentes et les défis, J.-P. Moulin, Colloque Chimie et énergies nouvelles (février 2021)
(8) Le prix Pierre Potier des lycéens 2020 (Vidéo YouTube)
(9) Les chimistes dans l’économie circulaire (série Les chimistes dans…, mediachimie.org)
Crédits : image d'illustration, licence CC0, PxHere
Vous qui n’avez pas la possibilité de venir à la Fondation de la Maison de la Chimie le 10 novembre 2021, vous pouvez assister en direct au « Colloque Chimie et Agriculture durable »
sur Mediachimie ou sur Youtube.
La captation des conférences sera par la suite disponible en ligne et leur mise à disposition sera indiquée sur la page d'accueil de Mediachimie.
La diffusion en direct sera disponible sur cette page.
Amphi : Session du matin (9h00 - 13h30), Session I de l'après-midi et session de clôture (14h30 - 18h00)
Session II de l'après-midi (14h30 -17h00)
Les versions écrites et vidéos des conférences du colloque « Chimie et énergies nouvelles » sont en ligne sur Mediachimie.
Notre futur énergétique fait actuellement l’objet de débats dans tous les media, et dans les milieux politiques et économiques. C’est un sujet fondamental pour la Société, l’Industrie, l’Économie et aussi pour la Formation des jeunes puisque l’énergie est l’un des principaux thèmes des programmes de terminales des différentes filières scientifiques.
Nous avons souhaité faire un point scientifique objectif sur les principaux thèmes de ces débats dans les conférences du colloque « Chimie et énergies nouvelles ». Les conférenciers ont été choisis parmi les meilleurs experts de la Recherche, de l’Industrie, et de la Politique économique.
Pour faire face aux besoins toujours croissants de la demande d’énergie en dépits d’économies envisagées et garantir l’accès de tous à des services énergétiques fiables et à des couts abordables, toutes les énergies décarbonnées flexibles, propres, abondantes capables de se substituer aux énergies fossiles seront nécessaires. Pour cela il est urgent d’innover mais aussi d’optimiser les technologies existantes en lien avec le développement durable :
- Quel pourra être le paysage de l’énergie en 2050 ?
- Quel sera l’avenir du nucléaire ?
- Quelle sera la trajectoire technologique et industrielle pour améliorer la compétitivité de l’hydrogène zéro carbone ?
- Quelle sera l’évolution des véhicules électriques et thermiques ?
Ces questions et beaucoup d’autres ont été traitées par les conférenciers pour faire de ce colloque un outil d’information objectif et un outil d’actualisation des connaissances utilisable par un large public.
Les bonbons et dragées se font une part belle dans le monde des sucreries, et au premier regard, leurs couleurs nous incitent à les goûter.
Nous connaissons tous ces petits personnages bleus de BD, logeant dans un village champignon et aussi déclinés en bonbons ! Mais comment les colorer en bleu ?
Caractéristiques physico-chimiques nécessaires pour être un colorant utilisable dans un bonbon
Le bonbon est par exemple constitué d’une solution aqueuse à laquelle on ajoute un colorant alimentaire, du sucre et de la gélatine à chaud. Les molécules colorées susceptibles d’être utilisées doivent pouvoir se disperser de façon uniforme au sein de la gélatine, résister aux différents traitements lors de la fabrication du bonbon et sur le long terme résister à la lumière et à l’oxygène de l’air.
Qu’en est-il du bleu patenté V ? (1)
Le bleu patenté V (i), au nom de code E 131, est un colorant alimentaire de synthèse, soluble dans l’eau. Il donne un bleu vif et répond à toutes les caractéristiques nécessaires précédemment citées. Il est ou a été le colorant bleu de nombreux bonbons et autres aliments et boissons. Mais Il est soupçonné d’un potentiel allergène. Son utilisation est réglementée en Europe et sa dose journalière admissible (DJA) a été diminuée en 2013 à 5mg/kg de masse corporelle (ii) par l'Autorité européenne de sécurité des aliments (EFSA).
Compte tenu que les enfants sont les principaux consommateurs de bonbons et que la demande du public vers des produits d’origine naturelle est forte, certains fabricants ont cherché à remplacer ce colorant par un autre issu d’une ressource naturelle, ce qui est effectif depuis 2020 pour les petites créatures bleues !
Le bleu dans les plantes sauvages
Même si bleuet, jacinthe des bois, myosotis, mûres et myrtilles …nous évoquent la couleur bleue, la nature nous offre très peu cette couleur parmi les plantes sauvages. Et si on arrive à en extraire les molécules responsables de leur couleur encore faut-il qu’elles répondent aux caractéristiques nécessaires à leur utilisation et que la matière première soit abondante. On comprend bien alors que ces plantes ne vont pas répondre à la demande.
La spiruline
La recherche a été longue pour trouver un composé naturel fournissant un bleu stable, répondant à tous les critères y compris l’innocuité et dont la production puisse être notable. La spiruline alimentaire s’est avérée le bon candidat. La spiruline est un ensemble de cyanobactéries (iii) alimentaires procaryotes (iv) qui se reproduisent dans des eaux chaudes (35 à 40°C) peu profondes et saumâtres (on parle aussi de microalgues) (v). Il existe plusieurs types de souches de bactéries et selon les zones géographiques (vi) et les conditions de production, la composition chimique varie (2). Toutefois en résumé les spirulines sont avant tout très riches en protéines. Elles contiennent également des glucides, un peu de lipides, des vitamines, des sels minéraux et des pigments. Ces différents constituants sont indépendamment recherchés pour des applications diverses (santé, alimentation, pigments, aquaculture, cosmétique…).
La couleur bleue issue de la spiruline
La spiruline contient d’une part des pigments verts (chlorophylles) et oranges (bêta-carotènes) et parmi les protéines qui la constituent il y a des phycocyanines qui possèdent un groupe chromophore bleu fixé à la chaine protéïque.
Les bêta-carotènes s’oxydent à l’air, les chlorophylles se dégradent à la lumière. Par contre les phycocyanines sont d’une part des anti-oxydants et d’autre part plus résistantes à la photo-destruction. Ainsi la spiruline séchée et longtemps exposée à l’oxygène de l’air et à la lumière, devient bleutée. Les phycocyanines représentent 12 à 17 % en masse (selon la souche) de la spiruline séchée.
La spiruline la plus utilisée est celle issue de microorganismes Arthrospira platensis. On en extrait (vii) tout particulièrement la C-phycocyanine qui, purifiée, concentrée et séchée, donne une poudre bleue, utilisée comme colorant alimentaire.
La C-phycocyanine peut très schématiquement être représentée selon
Chaine protéinique (viii)― groupe chromophore bleu

La structure de son groupe chromophore est représentée ci-contre (source https://www.rcsb.org/ligand/CYC)
La C-phycocyanine a été autorisée en 2013 par la FDA comme colorant alimentaire des gommes et bonbons et est en 2020 le seul colorant bleu naturel autorisé aux USA, Europe et Chine dans des applications alimentaires telles que les pâtisseries (glaçage, nappage…) laitages, gélatines, céréales…, des applications pharmaceutiques (enrobages de produits) et cosmétiques.
La phycocyanine est aussi très recherchée pour son pouvoir anti-oxydant.
Alors bonne dégustation, mais attention au sucre !
Françoise Brénon
(i) Le bleu patenté est utilisé sous forme de sel de calcium Ca(C27H31N2O7S2)2 ou de sodium Na(C27H31N2O7S2).
Sa formule développée est page 8 https://efsa.onlinelibrary.wiley.com/doi/pdf/10.2903/j.efsa.2013.3108
(ii) Source Avis scientifique sur la réévaluation du brevet Blue V (E 131) en tant qu’additif alimentaire EFSA Journal (2013)
(iii) Les cyanobactéries (cyano du grec ancien kyanos signifiant bleu) sont des bactéries qui synthétisent leurs molécules organiques comme les plantes, par photosynthèse. Afin de capter la lumière, elles utilisent des pigments présents dans leurs structures.
(iv)Un procaryote est un microorganisme unicellulaire dont la structure cellulaire ne comporte pas de noyau.
(v) Elles ont une configuration spatiale en forme d’hélice d’où le nom spiruline dérivant du latin spira (enroulement).
(vi) En 2018 la production mondiale provient de Chine à plus de 50 % (2). Parmi les autres pays producteurs, citons les USA (Hawaï), le Mexique, la Thaïlande… La France en produit en très petits tonnages.
(vii) Plusieurs procédés d’extraction sont possibles (2) et (3). Après une destruction de la membrane de la bactérie (désintégration cellulaire) tout en évitant la dénaturation des protéines, il faut séparer les protéines solubles dans l’eau, ce qui est le cas des phycocyanines, des autres protéines liposolubles et des lipides. Pour ceux-ci on essaie d’éviter des solvants organiques à impact environnemental. L’extraction à l’aide de CO2 supercritique répond par exemple à ce critère.
(viii) La structure de sa chaine protéïque est répertoriée sur le site PDB (Protein Data Bank) RCSB PDB - 1GH0: STRUCTURE CRISTALLINE DE LA C-PHYCOCYANINE DE SPIRULINE PLATENSIS
Pour en savoir plus
(1) Couleur et coloration des aliments, une simple affaire de chimie ? de Sylvain Guyot, La chimie et l’alimentation (EDP Sciences)
(2) Spiruline : Culture, production et applications, document très complet sur le sujet par Maryline Aber Vian, Techniques de l’Ingénieur publié le 10/03/2021
(3) Évaluation des méthodes d’extraction de la phycocyanine et son rendement à partir de spirulina platensis de Imène Lafri et coll., Agrobiologia
Le prix Nobel de chimie 2021 vient d’être attribué à deux chimistes un allemand Benjamin List et à un américain David MacMillan, pour « avoir développé un outil de construction de molécules : l’organocatalyse asymétrique ». L’Académie Nobel couronne ainsi deux secteurs très actifs de la chimie : la catalyse et la chimie asymétrique.
Pour fabriquer des molécules, qui nécessitent souvent un enchaînement de plusieurs réactions, que ce soit au laboratoire ou dans un procédé chimique industriel, on cherche à diminuer le nombre d’étapes et à les accélérer sans pour autant augmenter la température du milieu réactionnel. Pour cela on fait appel à des catalyseurs (1). Ces catalyseurs étaient souvent des métaux ou des complexes de métaux de transition, par exemple le platine pour les piles à hydrogène ou le rhodium pour les pots catalytiques. Or dans la nature il existe des enzymes capables de synthétiser des molécules complexes asymétriques comme le cholestérol ou la chlorophylle et tout à fait exemptes de métaux.
Avant d’aller plus loin, parlons de molécules asymétriques (2) (3). Ce sont des molécules présentant les mêmes atomes et les mêmes enchainements de liaisons mais qui dans les 3 dimensions ne sont pas superposables à leur image obtenue par symétrie par rapport à un miroir plan. Il en est ainsi de nos mains droite et gauche. Ces molécules sont dites chirales et les deux images ou molécules « miroir » sont des isomères appelés énantiomères. Or souvent ces deux molécules n’ont pas la même propriété. L’exemple le plus connu est celui du limonène. La configuration atomique R a un parfum d’orange et S de citron. En pharmacie ou en parfumerie il est essentiel de synthétiser l’isomère qui possède la propriété et pas l’autre d’où les applications de la catalyse asymétrique.
Les deux chercheurs ont essayé de résoudre cette énigme en utilisant des catalyseurs organiques simples et sans métaux. Benjamin List en observant les propriétés des enzymes doués de chiralité s’est aperçu que seuls quelques-uns de leurs acides aminés avaient une action. Il a essayé alors la proline un acide aminé simple comme catalyseur dans une réaction d’aldolisation (4), et chic ! Dans le produit de réaction un isomère présentant la même chiralité que son catalyseur était largement dominant.
À des milliers de kilomètres de là, David MacMillan était un spécialiste des catalyseurs métalliques asymétriques, coûteux et difficiles à appliquer industriellement. Il a alors testé des molécules organiques comportant un atome d’azote au sein d’une structure de type ion iminium attracteur d’électrons. Sur plusieurs essais il a constaté que certaines d’entre elles favorisaient l’une des molécules miroir à plus de 90%. Il venait aussi indépendamment de son collègue allemand d’inventer « l’organocatalyse organique ».
À leur suite se sont développées de nombreuses applications de molécules chirales aux propriétés essentielles en pharmacologie pour de nouveaux médicaments, en chimie des parfums pour la cosmétique, avec des procédés plus respectueux de l’environnement.
Un petit point d’histoire, c’est en 2001 que le prix Nobel de chimie avait été attribué pour la catalyse asymétrique à Knowles, Noyori et Sharpless via des complexes organométalliques.
Jean-Claude Bernier
7/10/2021
Pour en savoir plus
(1) Chimie et symétrie : chiralité, Dmitri Savostianoff, Chimie Paris n°337 (2012) p. 3-5 (lien vers http://www.mediachimie.org/ressource/chimie-et-sym%C3%A9trie-chiralit%C3%A9), les autres liens marchent)
(2) Polymères supramoléculaires et catalyse asymétrique, M. Raynal et L. Bouteiller, L’Actualité chimique n°430-431 (juin-juillet-août 2018) pp. 37-41
(3) Zoom sur la chiralité et la synthèse asymétrique (J.-P. Foulon, site Mediachimie.org)
(4) Comment passer de la musique à la chimie ? La réaction d’aldolisation (J.-P. Foulon, site Mediachimie.org)
Crédit illustration : Benjamin List and David W.C. MacMillan. Prix Nobel de Chimie 2021. Ill. Niklas Elmehed © Nobel Prize Outreach.
Lorsqu’une tumeur cancéreuse est détectée dans l’organisme il y a plusieurs stratégies pour l’éliminer : la chirurgie d’abord mais souvent associée à deux autres traitements, la chimiothérapie et la radiothérapie. Car même si l’essentiel de la tumeur a été retiré, l’amas de cellules cancéreuses peut être éliminé par la prise de médicaments qui réduisent ou stoppent la division cellulaire, c’est la chimiothérapie (1), ou bien localement par irradiation des cellules à l’aide de rayonnements énergétiques fournis par des isotopes radioactifs, c’est la radiothérapie (2).
Les inconvénients de ces méthodes sont connus. Les molécules toxiques utilisées en chimiothérapie atteignent non seulement les cellules cancéreuses mais également toutes les cellules du corps d’où des effets secondaires. Les rayonnements issus des sources radioactives sont soit des électrons (rayons β) ou des rayons X ou des rayons γ (3) qui provoquent des lésions sur les brins d’ADN dans les noyaux des cellules cancéreuses plus ou moins bien ciblées.
Les traitements peuvent être externes mais pour ne pas irradier la peau du patient on peut injecter un produit radioactif qui va attaquer les cellules cancéreuses, par exemple l’iode 131 pour la thyroïde, ou le phosphore 32 en cas de leucémie.
La particularité du traitement qui fait appel au plomb 212 vient du fait que le rayonnement énergétique est apporté par des particules α constituées de 2 protons et de 2 neutrons, bien plus grosses que les électrons et bien plus énergétiques mais que leur propagation se limite à quelques centaines de microns dans le corps.
| Particules β | Particules α | |
| composition | électrons | 2 neutrons + 2 protons |
| énergie | 0,1 KeV.µm-1 | 100 KeV.µm-1 |
| parcours dans le corps | Quelquesmm | quelques microns |
Tableau comparatif des rayonnements
On voit alors vite les avantages des particules α très ionisantes. Elles peuvent plus facilement dégrader l’ADN d’une cellule cancéreuse, et comme leur distance de propagation est mille fois plus petite que celle des électrons, la zone irradiée est comparable à la taille de la cellule que l’on veut ioniser sans que les cellules saines à côté ne soient touchées.
Les émetteurs de particules α semblent donc idéales pour le traitement de certains cancers à condition d’en trouver suffisamment de sources et de pouvoir les guider jusqu’aux cellules cancéreuses.
C’est ici qu’intervient la découverte d’un chercheur d’Areva (maintenant Orano) qui cherchait à valoriser des tonnes de minerai de thorium (4) qui leur restaient après extraction de l’uranium. L’idée de l’alphathérapie a ainsi germé dans les années 2006 et elle s’est précisée en 2012 et 2014 par des partenariats en oncologie avec des laboratoires pharmaceutiques européen et américain de la filiale Orano Med (5) en charge du développement industriel.
La chaine de désintégration du thorium (6) est un peu complexe et conduit à de nombreux intermédiaires.
232Th→ 228Ra + α 228Ra → 228Ac + β 228Ac →228Th + β 228Th → 224Ra + α
224Ra → 220Rn + α 220Rn →216Po + α Pour aboutir ensuite au Plomb 212 216Po → 212Pb + α --
Cet isotope est assez bien placé pour une utilisation radiopharmaceutique puisqu’il a une demi-vie de 11 h et se désintègre au bout d’une semaine donnant d’abord le bismuth 212 et enfin le plomb 208 en libérant des particules α.
Les séparations et extractions sont complexes et un fût de 350 kg de thorium 232 ne donne in fine que quelques dizaines de milligrammes de plomb 212.
Il faut ensuite guider ce « radio-émetteur » vers les cellules cancéreuses. Or celles-ci génèrent à leur surface des antigènes contre lesquels il faut apporter des anticorps capables de les reconnaitre.
La stratégie est d’abord de trouver un ligand du 212Pb qui puisse le chélater (*) pour éviter tout relargage du plomb dans le corps. C’est le TCMC (**) qui a été choisi car il a, de plus, la propriété de se coupler assez facilement avec des anticorps monoclonaux (***) qui vont reconnaître les antigènes produits uniquement à la surface des cellules cancéreuses (7) (8). Une fois les anticorps synthétisés on greffe à leur surface le complexe (TCMC-212Pb) et le vecteur ainsi formé va voyager dans le corps jusqu’à reconnaitre les cellules cancéreuses, et celles-là seulement, et les éliminer par le rayonnement α en préservant les cellules saines (9).

Schématisation de l'interaction antigène/anticorps dans une immunothérapie avec rayonnement α produit par le 212Pb
Les essais cliniques sont en cours aux États-Unis et bientôt en Europe. La filiale Orano Med investit en France plus de 100 M€ en Haute Vienne pour une plateforme industrielle dénommée ATEF (Advanced Thorium Extraction Facility) avec salle blanche répondant aux règlements de l’ANSM pour obtenir la qualification d’Établissement Pharmaceutique. L’ambition est de mettre sur le marché des traitements dès 2025. Les capacités de production pour plusieurs milliers de radiomédicaments sont prévues et même s’il n’y a que quelques dizaines de milligrammes de 212Pb par fût traité, Orano dispose de plusieurs milliers de fûts de thorium à valoriser où d’ailleurs la chaine des isotopes se reconstitue par radioactivité et désintégration naturelle.
Jean-Claude Bernier et Françoise Brénon
Septembre 2021
(*) Le cation central, ici Pb++, entre en interaction avec une molécule appelée ligand en formant une molécule stable. Le processus est appelé chélation et le composé formé un chélate ou complexe.

TCMC pour 2-(4-isothiocyanatobenzyl)-1,4,7,10-tetraaza-1,4,7,10-tetra-(2-carbamoylmethyl)cyclododecane
(***) Un anticorps monoclonal est anticorps synthétisé par des cellules (bactérie, levure…) sélectionnées et cultivées pour leur capacité à produire un anticorps particulier capable de traiter une maladie (Source : site Vidal).
Pour en savoir plus
(1) Petites et grosses molécules innovantes pour le traitement du cancer, conférence et article de Jean-Pierre Armand, Colloque Chimie et nouvelles thérapies, 13 novembre 2019
(2) La radioactivité, document du CEA
(3) Quelle dose moyenne de radioactivité reçoit-on en France, Jean-Claude Bernier (question du mois, Mediachimie.org)
(4) La découverte du thorium, J.-J. Berzelius
(5) Site de la société Orano Med
(6) La chimie pour la séparation et la gestion des déchets nucléaires, conférence et article de Bernard Boullis, Colloque Chimie et enjeux énergétiques, 14 novembre 2012
(7) Le plomb radioactif : arme de destruction ciblée des cellules cancéreuses, de Pauline Junquet et Solène Batut (site Culture Sciences Chimie)
(8) Développement d’un immunoconjugué cytotoxique ciblant le récepteur de l’IGF-1, conférence et article de Jean-François Haeuw, Colloque Chimie et nouvelles thérapies, 13 novembre 2019
(9) Les nanomédicaments : une approche intelligente pour le traitement des maladies sévères, conférence et article de Patrick Couvreur, La chimie et la santé, EDP Sciences ( 2010)
Crédits : Image d'illustration : Cellules cancéreuses par Sam Levin, licence CC BY 2.0 ; molécule TCMC site CultureSciencesChimie
Du 1er au 11 octobre, Mediachimie fête la science. Sur le thème "l’émotion de la découverte", venez découvrir une sélection de ressources en relation avec cette thématique.
Plongez au sein de laboratoires, de centres de recherche et d'entreprises innovantes avec les vidéos de la série Des Idées plein la Tech et les vidéos du Grand Prix des Jeunes Journalistes
- Manipulation génétique : des ciseaux moléculaires à double tranchant
- Caillebotte aux RX
- Diatomées, le pouvoir des trous
- Le propanolol, une pilule pour oublier ?
- Des nano plein les bronches
- Vive le CO2
- Olikrom, une voie lumineuse
Revivez des découvertes de chimie qui ont changé la vie quotidienne des hommes et même l’Histoire grâce aux vidéos « Petites histoires de la chimie » :
- La découverte de la quinine
- Goethe et la découverte de la caféine
- La pile électrique : tout a commencé avec des grenouilles
- La première couleur artificielle : le bleu de prusse
- Perkin et la mauvéine
Découvrez des métiers de la recherche mais aussi tous les autres présentés dans l’espace métiers de Mediachimie :
- Chercheur(euse)
- Ingénieur(e) génie des procédés- génie chimique
- Technicien(ne) d’analyse chimie
- Technicien(ne) chimiste
Et enfin venez vous amuser en apprenant et tester vos connaissances en vous mesurant aux quiz Mediachimie.
La Fête de la Science, ce sont également des milliers d'animations gratuites, partout en France. À cette occasion, la science investit les lieux publics et les chercheurs viennent à votre rencontre. Retrouvez les évènements près de chez vous sur le site https://www.fetedelascience.fr/
Les champions olympiques ont fait fort en athlétisme à Tokyo ! Des temps canons au 400 m haies, des records féminins battus au 100 m et 200 m, des records olympiques en demi-fond et aux 5 000 et 10 000 m, des sauts en longueur remarquables… De quoi faire mentir les spécialistes de la physiologie sportive (1) qui prévoyaient une limite humaine aux efforts et résultats sportifs.
En réalité ces progrès viennent bien sûr d’entrainements scientifiquement programmés, mais aussi d’avancées technologiques où la chimie a un grand rôle.
Prenons tout d’abord les « chaussures miracles » lancées par un grand nom de l’équipement sportif en 2020 baptisées « alphafly » ou « vaporfly » et copiées bien évidement par tous les grandes marques concurrentes. Elles ont plusieurs couches :
- une semelle externe élastique dotée de crampons très légers disposés en forme de pentagone
- une deuxième semelle interne rigide en composite carbone-carbone riche en fibres de carbone (2)
- des couches de mousse en polyéther à blocs de polyamide (PEBA) (3)
- une tige et un tissu qui maintiennent le pied en fibres imper-respirantes en PTFE (de type Gore-Tex®) (4)
Ces multicouches ont toutes une utilité : les crampons permettent d’accrocher la piste comme points d’appui pour l’élan, la mousse expansée souvent issue de polymères à blocs avec des polyamides donne l’élasticité et la légèreté à la chaussure et surtout restitue bien l’énergie aux pieds de l’athlète. De plus la semelle en carbone rigide apporte de la rigidité à la voûte plantaire et redonne aussi de l’énergie à la chaussure qui renvoie mieux et permet de mieux avancer.
Les chaussures sont un élément d’explication mais le sol et son revêtement participent aussi à l’avancée technologique. On se rappelle l’arrivée dans les années 70 des pistes en tartan, couplant un revêtement en caoutchouc et polyuréthane avec des agglomérats de gravier en sous-couches, qui ont déjà changé les performances des courses précédentes courues sur pistes cendrées. La piste à Tokyo en 2021 fabriquée sur mesure par l’entreprise italienne Mondo ne fait que 14 mm d’épaisseur. Au-dessous du polyuréthane sont disposés des granulés de caoutchouc en design hexagonal qui ménagent de petites poches d’air. La piste absorbe l’énergie des coureurs et la renvoie avec un effet « trampolino » dans le sens de la marche. Plusieurs coureurs ont dit qu’ils avaient l’impression de « courir sur de l’air » ou de « marcher sur des nuages » sur cette piste très rapide.
De plus les fabricants ont fait un réel effort de développement durable et par souci de l’environnement : les mousses de polyamides viennent d’un bioprocédé rendu célèbre par Arkema utilisant des graines de ricin (5) et leur expansion est faite par insufflation d’azote qui les garantit exempt de CFC, HCFC ou COV (*) (6). Par ailleurs le principal fabricant a mis en place une chaine de recyclage.
La conjonction des chaussures et de la piste apporte un progrès sur les temps de course en sprint et en fond de l’ordre de 2 à 4 % ce qui fait dire au roi du sprint Usain Bolt « avec ces chaussures je serais passé au 100 m sous les 9"50 ! »
Certains cependant critiquent ces records et les assimilent à du « dopage technologique » pour les privilégiés qui disposent de ces équipements. Ce n’est pas sans rappeler la polémique qui a accompagné les performances des nageurs qui étaient revêtus d’une combinaison en polyuréthane et élasthanne sur laquelle l’eau glissait comme sur les écailles de poisson (7). Elles furent ensuite interdites par les autorités des fédérations sportives internationales. Il n’en est pas de même pour ces chaussures innovantes qui avant d’être employées ont reçu l’agrément des comités sportifs et olympiques.
Il n’en reste pas moins que la discipline d’entrainement physique et psychologique des champions est très dure et pas à la portée de n’importe quel amateur. En cette fin août alors que se déroulent les jeux paralympiques que dire alors de la force morale qui anime ces athlètes handicapés qui concourent. Même si diverses prothèses de haute technologie peuvent parfois les aider (8), ce sont des années de souffrance et d’effort durant les entrainements qui leur permettent l’accès au podium.
Jean-Claude Bernier
Août 2021
(*) CFC chlorofluorocarbures, HCFC hydrochlorofluorocarbures, COV composés organiques volatils
Pour en savoir plus :
(1) Optimisation des performances, complexité des systèmes et confrontation aux limites, Jean-François Toussaint, in La Chimie et le sport, EDP Sciences (2011)
(2) Les composites carbone/carbone, J. Thébault et P. Olry, L’Actualité Chimique, n° 295-296 (mars-avril 2006)
(3) Comment faire des polyamides à partir de l'huile de ricin ? Du ricin au Rilsan® : une réaction de polymérisation à la française, Jean-Pierre Foulon, Réactions en un clin d’œil, Mediachimie.org
(4) Les textiles et les vêtements pour le sport, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, in La chimie dans le sport, collection collection Chimie et... Junior (2014)
(5) La grande aventure des polyamides, J.-C .Bernier et R.-A. Jacquesy, L’Actualité Chimique n° 360-361 (février-mars 2012)
(6) Chimie atmosphérique et climat, conférence et article de Guy P. Brasseur, colloque Chimie et changement climatique, novembre 2015
(7) Des textiles pour sportifs. Apport de la chimie pour améliorer confort et performances, Fabien Roland, in La Chimie et le sport, EDP Sciences (2011)
(8) Nouvelles prothèses, Serge Lécolier, Chimie Paris n°338-339 (2012)
Le plan de relance avec les milliards d’euros consacrés aux carburants propres, dont l’hydrogène, enflamme les médias mais aussi la recherche et l’industrie (1).
Confrontée aux critiques l’accusant de pollution, l’aviation commerciale devant la menace de boycott scandinave et de suppression de lignes intérieures françaises se devait de réagir. En fait, dès 2017, bien avant les recommandations de la CCC (Convention Citoyenne pour le Climat), un engagement de remplacement progressif du kérosène par des carburants bas carbone avait été signé entre le ministère de la Transition écologique, de l’Économie et le secrétaire d’État aux transports avec cinq groupes : Air France, Airbus, Safran, Total et Suez environnement. Il prévoyait une substitution programmée d’ici 2050 du kérosène par des biocarburants pour les transports aériens. Airbus vient aussi de lancer son projet de lancement de l’avion ZEROe (pour zéro émission) avec ADP et Air Liquide et d’autres partenaires européens et envisage très sérieusement pour 2035 un avion propulsé à l’hydrogène.
Pourtant dans le transport aérien, l’hydrogène avait mauvaise réputation depuis qu’en mai 1937 le zeppelin LZ 129 Hindenburg, après une traversée atlantique, s’était embrasé sur la base de Lakehurst près de New York faisant 34 morts et 20 blessés. Cette catastrophe mit fin à l’aventure aéronautique des dirigeables géants gonflés à l’hydrogène gaz léger mais très inflammable.
Les biocarburants pour l’aviation
La feuille de route pour le transport aérien implique une augmentation des biocarburants (2) mélangés au kérosène d’ici 2030 pour atteindre une réduction des émissions de 50% en 2050. Cette marche « pré-hydrogène » a déjà profité des recherches de l’IFPEN (IFP Énergies nouvelles) et de Total. Pour la France on se rappelle la reconversion de la raffinerie de La Mède condamnée à la fermeture et transformée en bioraffinerie avec un investissement de plus de 275 millions d’euros devant produire des agrocarburants avec le procédé HVO (Hydrotreated Vegetable Oil), un procédé français. Il avait en 2019 provoqué quelques remous de la part d’écologistes avec le projet de traiter de forts tonnages d’huile de palme (3). Cela n’a pas découragé le pétrochimiste qui a annoncé en 2020 la transformation de la raffinerie de Grandpuits (77) en investissant 500 millions d’euros dans une plateforme « zéro pétrole » afin de fournir 400 000 t/an de biocarburants majoritairement destinés au secteur aérien, à partir de graisses animales, huiles de cuisson usagées et végétales recueillies régionalement.
En juin 2021 un champion de la voltige aérienne a effectué entre Sarrebruck et Reims un vol acrobatique avec son avion à hélice et moteur thermique fonctionnant avec une essence renouvelable à 97% produite par le français Global Bioenergies et l’allemand Swift Fuel. Ce carburant utilise une méthode bien éprouvée par la PME française : on convertit par fermentation à l’aide d’une bactérie modifiée des résidus de betterave, d’amidon, de paille et de bois en isobutène qui par réaction avec l’hydrogène donne l’iso-octane. Il est l’un des constituants majeurs de « l’avgas », diminutif de « aviation gasoline », utilisé par les appareils à hélice. Pour Global Bioenergies ce débouché du bio-isobutène (4) vers les carburants d’aviation pourrait être un marché porteur comme l’est celui du cosmétique avec L’Oréal qui vient de lancer une gamme de maquillage à 90% d’origine naturelle.
L’hydrogène pour l’aviation
Pour l’hydrogène la copie à remplir est plus dure. On se rappellera utilement les contenus énergétiques des carburants : 1 kg de kérosène équivaut à 12 kWh et 1 kg d’hydrogène à 33 kWh, c’est donc à première vue un excellent vecteur énergétique. Mais, il y a un mais, comme il est très léger il ne fait que 3,5 Wh par litre et il faut le liquéfier à -250°C pour obtenir 2,8 kWh/litre, soit 4 fois moins qu’un litre de kérosène. Il faut donc des réservoirs quatre fois plus volumineux de type cryogénique si on l’utilise liquide ou composite haute pression si on l’utilise comprimé à 700 bars. D’ores et déjà Airbus annonce dès 2023 la création de deux centres de développement Zéro émission à Nantes en France et à Brême en Allemagne. Pourquoi Nantes ? Parce que l’usine nantaise a déjà la maitrise des caissons métalliques centraux de voilure des Airbus qui contiennent le carburant, depuis l’A320. Le technocentre de Nantes, lié à l’IRT (Institut de recherche technologique) Jules Verne pourra apporter ses compétences dans le domaine d’intégration des structures métalliques dans l’appareil et les essais cryogéniques sur les réservoirs d’hydrogène liquide. C’est un verrou complexe, car ces composants doivent être capables de résister aux cycles thermiques et de pression que subissent les avions en vol tout en conservant le carburant à -250°C. Ce défi est aussi celui de la distribution du précieux fluide auquel se sont attaqués Air Liquide et ADP avec Airbus (5).
Quelles sont les infrastructures nécessaires sur les deux aéroports français Roissy et Orly ? Pour ravitailler les avions soit on construit des unités d’électrolyse dans l’enceinte ou un lieu proche de l’enceinte soit on l’amène par pipeline en liaison directe avec un site industriel voisin. Le problème en 2021 c’est qu’il existe peu, de par le monde, d’électrolyseurs d’eau de puissance capables de délivrer plusieurs milliers de tonnes d’hydrogène par jour. Sachant qu’il faut environ 50 kWh pour produire 1 kg H2 il faudrait des électrolyseurs de 100 MW capables de délivrer environ 40 000 kg d’hydrogène par jour, sachant qu’un Airbus A350 consomme environ 48 t de kérosène pour la traversée transatlantique de 7000 km. Pour ce vol il faudrait environ 200 t d’hydrogène même avec de nouveaux moteurs Safran économisant plus de 10% de carburants, il faut donc multiplier les ressources d’hydrogène. On voit bien à ces chiffres que ce vecteur énergétique pourra être réservé aux courts et moyens courriers, compte tenu des dimensions possibles des réservoirs.
Autre défi que se posent les partenaires : hydrogène vert (6) ou hydrogène bas carbone ?
Il y a actuellement deux solutions bas carbone opérationnelles. Air liquide dispose de la technologie Cryocap™ (7) qui permet de capter le CO2 issu du steam-reforming (reformage à la vapeur d’eau du gaz méthane). C’est un « hydrogène dit bleu » ! Par ailleurs l’électrolyse de l’eau avec de l’électricité nucléaire est aussi un procédé bas carbone. On appelle « jaune » cet hydrogène !
Les verrous technologiques sont importants ; il faut pouvoir faire le plein en quelques dizaines de minutes compte tenu des rotations des avions, dans des conditions de sécurité et des conditions économiques qui permettront à l’aviation commerciale de survivre.
La feuille de route est rude mais l’objectif de voler en n’émettant que de l’eau et de l’azote est excitant non ?
Jean-Claude Bernier et Françoise Brénon
Pour en savoir plus :
(1) L’hydrogène au secours de l’économie européenne, Jean-Claude Bernier (editorial, Mediachimie.org)
(2) La chimie une solution pour l’avion de demain, Arnaud Charles, Noël Baffier et Jean-Claude Bernier (Chimie et ... en fiches - cycle 4, Mediachimie.org)
(3) La pétrochimie se met au vert, Jean-Claude Bernier et Françoise Brénon (éditorial, Mediachimie.org)
(4) Vers les biocarburants de 2e génération : l'exemple de l'isobutène biosourcé, Pierre Labarbe (Chimie et ...en fiches - Lycée, Mediachimmie.org).
(5) La propulsion des fusées et des futurs avions chez Air Liquide !, conférence et article de Pierre Crespi, Colloque Chimie, aéronautique et espace, 8 novembre 2017
(6) Qu’est-ce que l’hydrogène vert ? Françoise Brénon (Question du mois, Mediachimie.org)
(7) Ce procédé de fabrication de l’hydrogène consomme toutefois un hydrocarbure tel que le méthane selon le bilan CH4 + 2 H2O →4 H2 + CO2 mais le captage du dioxyde de carbone empêche son relargage dans l’atmosphère. Cryocap™ H2: solution cryogénique de captage de CO₂ (site Air Liquide).
Illustration : Airbus A320-271N, Wikimedia par Pedro Aragão, Licence CC BY-SA 3.0, Lien
On trouve toutes sortes de recettes dites « de grand-mère » sur Internet pour nettoyer son argenterie. Dans ces dites recettes il est même précisé « sans utiliser de produit chimique » !!! Est-ce vrai ?
D’où provient le noircissement de l’argent ?
Les aliments contiennent naturellement des sulfures comme l’albumine du blanc d’œuf, la cystéine présente dans les protéines, des sulfures organiques dans les choux, les oignons, certaines boissons…
Dans l’air il peut y avoir des traces de sulfure d’hydrogène (H2S, reconnaissable à son odeur « d’œuf pourri » !) et de sulfure de diméthyle (H3C-S-CH3) qui est le plus abondant des composés biologiques contenant du soufre émis dans l'atmosphère.
C’est ainsi la présence de ces sulfures qui sont majoritairement responsables de la formation de dépôts noirâtres à la surface d’un objet en argent. L’argent a été oxydé par le dioxygène de l’air et en présence de ces sulfures s’est recouvert de sulfure d’argent Ag2S, noir, très stable (1).
« Faire l’argenterie » consiste donc à éliminer ce sulfure d’argent.
Une recette : « Nettoyer son argenterie dans un bain de sel ».
Élucidons cette « recette de grand-mère » dont le titre interpelle le chimiste ! En effet ce titre est trompeur ! Ce n’est pas le sel qui nettoie l’argenterie.
Regardons de plus près la recette. Prendre une feuille d’aluminium. La disposer dans une cuvette en plastique (éviter un autre métal). Mettre une poignée de gros sel dans une casserole d’eau que l’on porte à ébullition. Puis verser cette eau salée chaude dans la cuvette. Introduire délicatement (sans se brûler) l’objet en argent à nettoyer et le poser au contact de la feuille d’aluminium. Laisser agir plusieurs minutes à 1 heure selon l’état d’oxydation de l’argent. Il est précisé que si l’objet en argent est très noir, on peut l’envelopper avec la feuille d’aluminium pour plus d’efficacité. Il est aussi dit que l’on peut ajouter du bicarbonate. Rincez puis séchez avec un chiffon très doux.
Notons que cette recette fonctionne bien.
Alors quels rôles jouent ces différents ingrédients ?
Le composé essentiel à la réussite de l’opération est ici l’aluminium. C’est un métal très réducteur. Il attaque le sulfure d’argent qui était un état oxydé de l’argent. L’argent est régénéré. Une partie de l’aluminium s’oxyde en ions Al3+. Compte tenu du pH de la solution ces ions précipitent sous forme d’hydroxyde d’aluminium, à la surface de l’aluminium qui se ternit.
La réaction (2) mise en jeu est
3 Ag2S + 2 Al +6 H2O → 6 Ag + 2 Al(OH)3 + 3H2S
On est en présence d’une pile (3), la pièce en argent étant au contact de la feuille d’aluminium. Si l’on enveloppe la pièce en argent par l’aluminium le contact entre les 2 métaux est meilleur facilitant ainsi les échanges d’électrons entre l’aluminium et le sulfure d’argent déposé sur l’objet en argent.
Quel est le rôle du sel ? Le sel est du chlorure de sodium (NaCl) qui se dissout sous forme d’ions sodium (Na+) et chlorure (Cl-). Il favorise les transports des ions (4) en solution mais n’intervient pas dans le bilan chimique.
La chaleur a pour but d’accélérer la réaction.
H2S : si vous avez déjà fait l’expérience, vous avez constaté l’émanation d’une mauvaise odeur. Elle est due à la formation du sulfure d’hydrogène produit durant la réaction et dont le dégazage est favorisé par la chaleur.
L’ajout éventuel du bicarbonate de sodium permet de stabiliser le pH vers 8,3 ce qui limite le dégazage de H2S.
Précautions
- Prenez soin de ne pas traiter de la même façon un bijou en argent avec des pierres fines incrustées. Ce mode opératoire ne concerne que des objets et bijoux en argent massif ou des couverts argentés (5).
- D’autres recettes proposent d’ajouter du vinaigre et non du bicarbonate. C’est à éviter car cela favorise la formation de H2S.
- Dans tous les cas aérer la pièce lors de ces manipulations.
Autres méthodes
- Frotter avec du carbonate de calcium ou avec une pâte de bicarbonate et de gros sel à confectionner soi-même. Il s’agit alors seulement de frotter et d’abraser la surface pour éliminer les traces de sulfures d’argent. Cela ne peut convenir qu’à des objets peu noircis et ne permet pas d’éliminer les traces restantes de sulfure d’argent piégés dans les micropores de la surface de l’objet.
Outre la faible efficacité, les risques sont de rayer l’argent qui est un métal assez mou et qui gardera les traces de ces rayures bien que les grains de bicarbonate et de gros sel soient estimés comme pas trop durs. De manière générale il vaut mieux éviter de frotter les objets en argent.
- Frotter avec une brosse à dent trempée préalablement dans du jus de citron : toujours abraser avec risque de rayures et de toute façon le citron n’est pas un acide capable de dissoudre Ag2S.
- Les professionnels de la restauration des objets d’art, de la bijouterie et des restaurants utilisant des couverts en argent pour leurs clients sont amenés à entretenir très souvent l’argenterie. Ils utilisent des produits à action très rapide dans lesquels ils les trempent. Le principe actif est alors la thio-urée qui réagit sur le sulfure d’argent l’éliminant ainsi de la surface de l’argent (6). Un rinçage soigneux termine l’opération. Il est indispensable de manipuler ces produits avec des gants et de porter des lunettes afin d’éviter tout contact avec la peau et les yeux.
Françoise Brénon et l’équipe question du mois
(1) En présence de sulfure d’hydrogène et d’oxygène de l’air, le sulfure d’argent noir, très stable, se forme selon
4 Ag + 2 H2S + O2 →2 Ag2S + 2 H2O
(2) Cette réaction est très favorable car sa constante d’équilibre vaut 10140 >>1
Les données nécessaires à ce calcul, E° (Ag+ / Ag) = 0,80 V ; E° (Al3+ / Al) = - 1,66 V ; pKs (Ag2S) = 49,2 ; pKs (Al(OH)3) = 33 ;
H2S : pKa,1 = 7,05, pKa,2 = 12,9 ; pKe = 14, sont issues de Les réactions chimiques en solution de G. Charlot (Masson).
(3) L’aluminium est le pôle négatif, c’est l’anode où se passe l’oxydation :
Al + 3 H2O → Al(OH)3 + 3 H+ + 3e-
Le pôle positif est constitué du sulfure d’argent déposé sur l’argent. Il s’y passe la réduction :
Ag2S + 2 H+ + 2e- → 2Ag + H2S
(4) Le sel dissout joue ici le rôle de l’électrolyte de la pile.
(5) Les couverts dit « en argent » sont rarement en argent massif. Ils sont en général en cuivre ou alliage de cuivre sur lequel a été déposé une fine couche d’argent.
(6) La thio-urée, notée de façon simplifiée Tu, a pour formule H2N-CS-NH2.
Si le mode opératoire est utilisé depuis le milieu du 20e siècle, la réaction mise en jeu suscite encore des questions. D’après les publications les plus récentes il est proposé 3 types d’interprétation :
- Soit une complexation (écrite ici en milieu acide) mettant en jeu la formation d’un complexe mononucléaire de Ag(I) selon
Ag2S + 2H+ + 2n Tu → 2 AgTun+ + H2S, n pouvant aller de 1 à 4. - Soit la formation d’un complexe binucléaire de l’Ag(I) selon
Ag2S + 2H+ + n Tu → Ag2Tun2+ + H2S, n allant de de 1 à 6 avec une forte présomption pour la forme majoritaire Ag2Tu42+. - Soit enfin la formation d’un composé éliminant Ag2S de la surface de l’argent selon
Ag2S + 2 CS(NH2)2 → 2 Ag-S-S-C(NH2)2
Sources :
- Métallurgie de l’argent § 6.2.1. in Les Techniques de l’Ingénieur (2006) et Silver and Acid-thiourea Silver Dips: Rinsing and Aging Monitored by Electrochemistry, L.Selwyn et W. R. McKinnon, Studies in Conservation (2021) 66:2, 98-112
- Potentiometric study of silver complexes with thiourea in acid media, P. Lukinskas et al. , Journal of Coordination Chemistry (2008) 61:16, 2528-2535
- Reaction of Thiourea With Silver Sulfide Tarnish Layers On Silver Surfaces, Ariga Allehyari (Californie State University, 2020)
33 lycéens parmi plus de 2 500 jeunes de toute la France et des lycées français de l’étranger ont participé aux épreuves finales du concours national des 37ème Olympiades Nationales de la Chimie.
Le palmarès de cette édition des ONC a été dévoilé ce jeudi 27 mai 2021 au lycée d’Arsonval (Saint-Maur-des-Fossés) à l’issue des épreuves.
PALMARES 2021 DU CONCOURS SCIENTIFIQUE
1er prix : Jules Nicoud, Terminale, LP Niepce-Balleure (Chalon-sur-Saône) – Académie de Dijon
2e prix : Romain Bothereau, Terminale, Lycée Louis Vincent (Metz) - Académie de Nancy-Metz
3e prix : Jade Ntsiegori, Terminale, Lycée Galilée (Franqueville Saint Pierre) - Académie de Rouen
PALMARES 2021 DU CONCOURS « PARLONS CHIMIE »
1er prix : Lycée Pierre Mendès France de Tunis, Tunisie (Académie AEFE), représenté par Khalil Bibih et Amine Zghal (Première) pour « Gel Daniels »
2e prix ex-aequo : Lycée Blaise Pascal d'Abidjan, Sénégal (Académie AEFE), représenté par Marèse Burtz et Nicolas Dioubaté (Terminale) pour « Le gel hydro cacaolique »
2e prix ex-aequo : Lycée Franco Hondurien, Tegucigalpa, Hondurasl (Académie AEFE), représenté par Flavia Antonella Arguelles et Vladimir Herrera Nativie (Première) pour « Un trésor qui s'ignoire »
Retrouvez les palmarès complets et les vidéos des trois projets primés du concours Parlons Chimie sur le site des Olympiades de la chimie
Télécharger le dossier de presse (PDF)
La Fondation de la Maison de la chimie partenaire depuis la création de ces Olympiades félicitent tous les candidats et invitent les élèves de terminales à participer aux 38ème Olympiades en 2021-2022 dont le nouveau thème sera Chimie et Cosmétique.
Pour plus d’informations rendez-vous sur le site des Olympiades de la chimie.
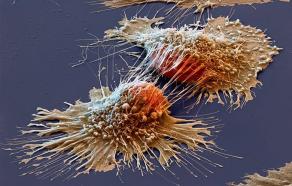
Les chercheurs de l’Institut de la vision (1) avec le professeur Jean Alain Sahel, l’Institut d’ophtalmologie de Bâle et le concours d’une start-up GenSight Biologics viennent de réussir récemment une performance clinique sur un patient aveugle. Depuis plusieurs années ils ont développé la thérapie « optogénétique » afin de redonner la vue à des patients devenus aveugles.
Cette approche thérapeutique nous avait déjà été signalée et décrite en 2017 lors du colloque « La chimie et les sens » à la Maison de la Chimie par le docteur Serge Picaud de l’INSERM (2). Cette incroyable innovation repose sur l’utilisation du système photosensible d’une algue unicellulaire qui est capable de se déplacer vers une source de lumière. Le principe de base est dû à une protéine qui sous la perception de la lumière ouvre un canal ionique dans la cellule et produit donc un courant qui agit sur le déplacement de l’algue (3). Les chercheurs, par biochimie, ont réussi à extraire le code génétique de cette protéine de la membrane des algues, à l’aide d’un vecteur viral de type virus adéno-associé (AAV) classiquement utilisé en thérapie génique. Ce vecteur est injecté dans l’œil, il diffuse dans la rétine et pénètre les neurones résiduels. Il a été montré que cette protéine photosensible est alors exprimée dans les cellules ganglionnaires de la rétine qui peuvent ainsi envoyer des signaux aux neurones du cerveau en fonction de l’intensité lumineuse reçue. Après des essais menés sur des souris puis sur des primates, les premiers essais cliniques de phases I et II en concentration progressive et essais de toxicologie et de rejets possibles immunitaires sont assez positifs. Ils ont cependant montré qu’il fallait des intensités lumineuses très élevées afin d’obtenir un stimulus conséquent chez les patients. D’où la nécessité de recourir à des lunettes spéciales qu’ont mises au point deux start-up spécialisées. Ces lunettes sont dotées de micro-caméras qui captent les changements d’intensité lumineuse et les retransmettent à l’œil au moyen d’une sorte de vidéoprojecteur, en images virtuelles monochromes, projetées à forte intensité sur les cellules ganglionnaires de la rétine qui peuvent ainsi envoyer un stimulus correct au cerveau.
C’est donc tout récemment en 2021 qu’un patient ayant perdu la vue par la mort des cellules photoréceptrices de la rétine, conséquence d’une rétinopathie pigmentaire, a retrouvé partiellement la vue au cours de cet essai clinique. Cette maladie génétique dégénérative de l’œil se caractérise par une perte progressive de la vision. Les chercheurs pensent aussi que cette approche par protéines photosensibles peut s’appliquer à d’autres pathologies de la rétine dont la dégénérescence maculaire qui se lie à l’âge de plus en plus élevé de nos concitoyens.
Il est remarquable que ce qui avait été annoncé en 2017 par une conférence en guise d’interrogation à la Maison de la chimie : « Faire revoir un aveugle avec le système photosensible d’une algue : bientôt une réalité ? » (2) soit vraiment devenu une réalité, 4 ans après, à partir d’une source naturelle (4) grâce aux biochimistes, ophtalmologues et star-up français et suisses.
Jean-Claude Bernier
Mai 2021
Pour en savoir plus
(1) La rétine en silicium (vidéo Les idées Plein la Tech)
(2) Faire revoir un aveugle avec le système photosensible d’une algue : bientôt une réalité ? conférence et article de Serge Picaud, Colloque La chimie et les sens, 22 février 2017
(3) Zoom sur la valorisation des algues Jean-Pierre Foulon
(4) Nature et chimie : des alliées pour accéder à de nouveaux médicaments conférence et article de Janine Cossy, Colloque Chimie et nouvelles thérapies, 13 novembre 2019
Les Olympiades Nationales de la Chimie auront lieu les 26 et 27 mai 2021.
La remise des prix du concours scientifique aura lieu le jeudi 27 mai à 17h, à la suite des épreuves. Elle se déroulera sans public, par respect des consignes sanitaires, mais sera postée sur la page Facebook des Olympiades.
Les soutenances orales du concours Parlons Chimie se dérouleront exclusivement cette année par visioconférence. Les résultats seront dévoilés en même temps que le palmarès du concours scientifique.
En mai 2021 la commémoration du bicentenaire de la mort de Napoléon 1er a suscité de nombreux articles et livres qui ont parfois créé la polémique sur les qualités et défauts de l’empereur français. Peu ont rappelé combien la science et ses applications avaient été l’objet d’attention particulière de la part du souverain. Car dès sa formation il montre un penchant marqué pour les mathématiques et les sciences physiques qu’il gardera au cours de sa carrière.
Général commandant de la campagne d’Italie il écrit : « Le peuple français ajoute plus de prix à l’acquisition d’un savant mathématicien qu’à celle de la ville la plus riche ou la plus populaire ». Surprenante déclaration d’un général en chef de l’armée d’Italie qui de plus s’est fait accompagner par Monge et Berthollet pour aussi séduire à sa table des savants italiens comme Volta spécialiste des courants électriques et de l’électrochimie (1).
À son retour il veut aussi connaître la communauté scientifique et avec l’aide de ces deux mêmes mathématicien et chimiste se fait élire à l’Institut en décembre 1797. Il s’y comporte comme un membre ordinaire mais suscite un intérêt croissant qu’il s’empresse de communiquer à la nation par les journaux.
C’est ainsi que se bâtit la curieuse expédition d’Égypte qui fait s’embarquer 32000 hommes en mai 1798 à Toulon mais aussi la Commission des sciences et des arts avec plus d’une centaine de scientifiques issus de l’Institut et de l’École polytechnique créés respectivement en 1795 et 1794. C’est encore Monge et Berthollet aidés par Joseph Fourier qui animeront les recherches et explorations jusqu’au retour de Bonaparte et le rapatriement de la Commission en 1803. La rédaction d’un ouvrage monumental se poursuivra jusqu’en 1809 avec une masse incroyable de résultats historiques, géographiques et scientifiques.
Après le 18 brumaire le premier consul crée en 1801 la Société d’encouragement à l’industrie nationale qui rassemble les élites savantes autour de projets industriels. Il confiera ainsi à des scientifiques de hautes fonctions politiques. C’est ainsi que le chimiste Antoine François Fourcroy sera directeur de l’Instruction publique et le chimiste Jean Antoine Chaptal sera ministre de l’Intérieur.
Mais qui sont donc ces chimistes qui doivent en partie à Bonaparte puis à Napoléon leur réussite ?
C’est tout d’abord Claude Louis Berthollet (2), fils de notaire, né à Talloires (duché de Savoie appartenant alors au royaume de Sardaigne), qui effectue des études de médecine à Turin. À Paris il devient médecin du Régent, le duc d’Orléans, qui met à sa disposition son laboratoire du Palais Royal. En 1780 il polémique avec Lavoisier sur le rôle de l’oxygène mais reconnait vite son erreur et publie avec lui la célèbre Méthode de nomenclature chimique en 1787 qui marque les débuts de la chimie moderne. Sa grande découverte en 1789 est le blanchiment des fibres de lin par des solvants chlorés qui donne un grand essor à la culture et au textile du lin en supprimant le long blanchiment (2) sur pré. Il est nommé professeur de chimie à l’École polytechnique et participe avec plusieurs collègues à l’expédition d’Égypte où il se lie d’amitié avec Bonaparte. En 1801 il publie son ouvrage Recherche sur les lois de l’affinité où l’on trouve l’analyse de nombreux corps de compositions jusqu’alors inconnues. Chargé d’honneurs et sénateur comblé il fonde la Société d’Arcueil et le laboratoire où se retrouveront de nombreux chimistes pour y mener de nouvelles expériences jusqu’en 1822.
Antoine François Fourcroy (3) s’est vu confier la chaire de chimie au « Jardin du Roi » en 1784. Fin politicien et bon orateur il siège à la Convention et survivra aux diverses vagues de la Révolution en se chargeant déjà de la réforme de l’instruction publique. Il intègre l’Institut et en sera le président de la section chimie en 1797. Après le 18 brumaire Bonaparte le nomme conseiller d’Etat. Préoccupé par l’état sanitaire déplorable, il crée les écoles de santé et rédigera les textes fondateurs, souvent retravaillés par Napoléon, de l’Université impériale chargée de gérer et contrôler l’ensemble des établissements d’enseignements de l’Empire et créée par décret en 1806.
Louis Nicolas Vauquelin (4) venu d’une famille pauvre normande monte à Paris où il tombe malade et erre dans les rues jusqu’à ce qu’un pharmacien Cheradame le recueille et l’instruit. Celui-ci, émerveillé par son intelligence le présente à un ami de la famille, A.F. Fourcroy. Celui-ci le prend dans son laboratoire et le fait connaître dans le milieu scientifique. Nommé professeur en frimaire an IV, admis à l’Institut il participe à la rédaction des Annales de chimie, puis avec ses collègues chimistes part chercher les tonneaux de salpêtre par toute la France pour fournir des explosifs aux armées de la patrie en danger. Pour obtenir le poste de professeur à la faculté de médecine il passe vite le doctorat en médecine. Par ses travaux il découvre la strychnine avec Pelletier et Caventou et dans ses travaux sur les plantes isole plusieurs acides aminés l’asparagine, des pectines, la nicotine, l’urée urinaire. En chimie minérale il découvre l’élément chrome et un nouvel élément, le glucinium qui sera prendra plus tard le nom de béryllium.
Joseph Louis Gay-Lussac (5), fils d’un juge à Pont-de-Noblat en Haute Vienne. Ce n’est qu’après la mort de Robespierre qu’il vient à Paris où il apprend l’anglais et les mathématiques. Admis à l’École polytechnique en 1797 à 19 ans, il suit les cours de chimie de Fourcroy, Vauquelin, Chaptal et Berthollet. Rien d’étonnant à ce qu’il devienne l’assistant de Berthollet et participe aux travaux sur le traitement des fibres de lin par les composés chlorés (6) dans le laboratoire d’Arcueil. Accueilli à l’Institut en 1806 il devient professeur de chimie à Polytechnique puis au Muséum d’histoire naturelle et à la faculté des sciences de Paris. Ses travaux sur la chimie et la thermodynamique des gaz font autorité comme ses travaux sur le magnétisme qui lui donnent l’occasion de battre des records d’altitude en ballon. C’est avec Thenard qu’il isole le potassium et découvre le bore. Mais il a aussi beaucoup de collaborations avec l’industrie de l’acide sulfurique et du verre puisqu’il présidera le conseil d’administration des glaces de Saint-Gobain (7).
Jean Antoine Chaptal (8). Voilà encore un chimiste qui a débuté par des études de médecine à Montpellier en 1777. Mais, passionné il se rend à Paris pour étudier la chimie. Son oncle l’aide à construire des ateliers où il améliore la production d’acide chlorhydrique. Sa fabrique se diversifie et prend de l’essor, ses produits sont connus dans toute l’Europe. C’est revenu à Montpellier dans la chaire de chimie qu’il se penche sur la formule de Lavoisier de transformation du sucre en alcool. Il publie sa doctrine en 1799 sur la vinification du vin. Son traité sur « la chaptalisation » du vin en 1807 révolutionne l’œnologie (9). À Paris, professeur de chimie végétale à Polytechnique, membre de l’Académie des sciences il poursuit ses activités industrielles et politiques puisqu’en janvier 1801 il est nommé ministre de l’Intérieur et ce sera lui qui élaborera la loi qui institue préfets, sous-préfets et arrondissements. Il démissionnera en 1804 pour être nommé sénateur. Outre ses écrits sur la vinification on lui doit la fabrication artificielle de l’alun, du salpêtre et d’un type de ciment.
Armand Jean François Seguin. Collaborateur de Lavoisier et cobaye humain pour ses essais sur la respiration, très bon expérimentateur, il fit fortune en inventant une méthode rapide de tannage des cuirs à base d’acide sulfurique et de tannins divers. Fournisseur de cuir pour les armées de l’Empire il installa une grande manufacture sur l’île de Sèvres sur la Seine qui traitait plus de 100 000 peaux par an. Sa fortune lui permit d’acheter plusieurs châteaux, mais les affaires périclitant, des spéculations aventureuses l’obligent à vendre une bonne partie de ses immeubles et à transformer sa manufacture en un haras pour chevaux de course. Il réservait ses communications scientifiques sur l’opium ou le quinquina à l’Académie dont il était correspondant. Son île sera industrialisée bien plus tard en 1925 par Renault et s’appellera bien sûr l’île Seguin.
Curieux destins pour ces chimistes qui surent survivre aux changements radicaux de régimes, de la royauté à la Restauration en passant par la Révolution, le Consulat et l’Empire. Au cours de ces changements sociétaux, ils ont cependant jeté les bases de la chimie moderne et initié les débuts d’une industrie nationale. Faut-il y voir le sens de l’investigation, de la patience, de l’observation et du pragmatisme des chimistes, pour surnager aux vagues parfois sanguinaires des révolutionnaires et se glisser dans un ordre nouveau qui fera leur fortune, mais dictatorial ?
Jean-Claude Bernier et Françoise Brénon
Mai 2021
Pour en savoir plus
(1) La pile électrique : tout a commencé avec des grenouilles
(2) Berthollet (1748-1822) et ses œuvres
(3) Antoine François de Fourcroy (1755-1808), promoteur de la loi de germinal an XI
(4) Conférence de M. le Professeur Delépine : les œuvres chimiques de Vauquelin
(5) Louis Joseph Gay-Lussac (1778–1850)
(6) Berthollet, le pharmacien Curaudau et l’identification du chlore
(7) Comment faire des vitrages avec du sable ? La réaction de fusion du verre
(8) Chaptal (1758–1822)
(9) De la vigne au verre : tout un art ?
Deux programmes pour verdir l’Europe
Connaissez-vous le CBE ou Circular Bio-based Europe qui succède depuis février au BBI JU ou Bio-based Industries Joint Undertaking ? Non pas vraiment ? Eh bien ce sont deux programmes européens.
Le premier, créé en 2014, a été basé sur une collaboration public–privé entre la commission et le consortium des bioindustries composé de plus de 100 entreprises dont plusieurs dizaines de la chimie. Sous la forme d’un « Public Private Partnership »il a été doté de 2,7 Mrd€ dont 1 Mrd issu de Bruxelles et 1,7 Mrd venant des industriels.
Son successeur jusqu’en 2027 devrait aussi mobiliser 2 Mrd€. Les réponses aux appels d’offres sont sélectionnées par un groupe mêlant les représentants des États et le comité scientifique. Ces dispositions ont permis de créer onze bioraffineries (1) en Europe dont trois en France, en réduisant les risques des investissements dans ces industries biologiques et en les connectant avec le marché pour créer une bioéconomie durable et compétitive en Europe. Elles sont dénommées « flagships » ou « bioraffineries phares ».
Voyons les résultats pour la France qui prend la première place de ce programme puisque trois projets y sont aboutis.
RESOLUTE – Un biosolvant non toxique à partir des déchets ligno-cellulosiques
C’est un projet mené par la société Circa spécialisée dans la fabrication des solvants organiques biosourcés (2). C’est la production à grande échelle d’un nouveau solvant non toxique à partir de résidus forestiers pour répondre à la demande de l’industrie des pâtes et papiers de valoriser ses déchets et de diversifier ses activités.
Circa avec l’université de York et d’autres partenaires dont AgroParisTech a mis au point depuis plusieurs années un procédé de fabrication de la levoglucosénone (LGO) intermédiaire pour les polymères spéciaux, des parfums et des actifs pharmaceutiques.
Mais le principal débouché commercial est le cyrène obtenu par hydrogénation du LGO (voir figure) solvant aprotique dipolaire et chiral qui va remplacer avantageusement le NMP (N-méthyl-2-pyrrolidone) et le DMF (N,N-dimethylformamide) qui sont sous pression réglementaire à cause de leur toxicité. Après avoir reçu l’approbation de l’ECHA (3) pour son biosolvant et investi plusieurs millions d’euros pour des pilotes produisant 100 tonnes de cyrène par an, une unité industrielle est en cours de construction sur le site chimique de Carling Saint-Avold pour produire environ 1000 tonnes fin 2022.
Suite à des travaux universitaires du CSIC de Madrid, le cyrène s’est révélé avoir les propriétés chimiques et physiques idéales pour l’exfoliation du graphite et les dispersions du graphène. C’est un nouveau débouché high-tech qui s’ouvre alors pour la commercialisation des encres pour l’électronique et les revêtements conducteurs.
AFTERBIOCHEM – Comment fabriquer des acides à partir des pulpes de betterave
C’est un deuxième « flagship » porté par la société Afyren spécialisée dans l’ingénierie en biologie. Elle a investi depuis 2016 dans un procédé qui convertit les déchets agroindustriels de betterave issus de l’industrie sucrière (4) en « building blocks » par fermentation anaérobie, puis dans une deuxième étape à les transformer en acides carboxyliques R-COOH. Grâce au programme européen BBI JU et la contribution de Bpifrance le projet industriel s’implante lui aussi sur la plateforme attractive Chemesis de Saint-Avold qui dispose de services partagés entre les entreprises chimiques du site. C’est un investissement de plus de 60 millions d’euros et la création de 60 emplois qui permettront à Afyren de produire dès 2022 16.000 tonnes d’acides acétique (5), propanoïque, butanoïque (butyrique) et pentanoïque (valérique)… aux applications multiples en agroalimentaire, lubrifiants, cosmétiques, plastifiants et pharmaceutique.
FARMŸING – synthétiser des protéines à partir de déchets organiques
Le troisième « flagship » français est porté par la société Ÿnsect spécialisée dans la production de protéines pour l’alimentation animale (6). C’est sans doute le plus original bien que le terme de bioraffinerie ne soit pas adéquat. C’est probablement la plus grande ferme horizontale d’Europe qui s’implante à Poulainville près d’Amiens. Sa production bien maitrisée par Ynsect et protégée par une trentaine de brevets consiste à « industrialiser » la larve de Tenebrio molitor connue sous la dénomination du ver de farine qui consomme pour grossir toutes sortes de matières organiques, graisses, végétaux, déchets ménagers… et qui est une source de nutriments naturels pour de nombreux animaux, poissons, volailles, porcins, chiens et chats…
Cofinancée par BBI JU, la région Hauts-de-France et divers fonds d’investissement, cette ferme qui va s’élever sur 40 000 m2 et 35 mètres de hauteur sera économe en eau et en énergie et devrait dès 2022 produire 1500 tonnes de protéines par mois. Cette unité, écoresponsable et durable économiquement, peut éviter une pêche supplémentaire de poissons sauvages, l’importation de soja et la diminution d’entrants azotés pour les produits et plantations destinées à l’alimentation animale.
Pour sourire, signalons un autre débouché : déjà plusieurs firmes commercialisent aussi pour l’apéro (7) ces vers Tenebrio molitor cuisinés et à croquer, d’une saveur comté-pointe de muscade rappelant l’amande et la noix de cajou riches en protéines et oméga 3 et 6 ! À votre santé !
Une nécessaire adaptation des bioraffineries au marché concurrentiel
Pour rester sérieux, il est clair que ces « bioraffineries » vont commercialiser des produits à forte valeur ajoutée dont les prix à la tonne vont permettre une rentabilité qui assurera leur durabilité sur le marché.
Cela contraste avec les difficultés que rencontrent les bioraffineries de la Mède ou de Grandpuits d’une part pour assurer un approvisionnement en graisse animale, huile de palme ou de cuisson usagée et d’autre part pour commercialiser des carburants que l’on peut directement incorporer dans le kérosène. En effet, le prix à la tonne, trois à quatre fois celui du kérosène classique, et les récentes fermetures de vols intérieurs vont rendre difficile l’essor commercial sans mesures d’assistance, preuve à l’appui que la bioingénierie en chimie a son créneau dans les produits et intermédiaires chimiques de valeur.
Jean-Claude Bernier
Avril 2021
Pour en savoir plus
(1) Introduction aux bioraffineries et La bioraffinerie de Bazancourt-Pomacle, L'Actualité chimique n° 375-376 (2013) pp. 46-48 et. 49-55
(2) Les solvants biosourcés : opportunités et limitations, P. Marion et F. Jérôme, L’Actualité chimique n° 427-428 (2018) pp. 91-94
(3) L’évaluation des substances chimiques dans le cadre de la mise en œuvre de REACH, conférence et article de C. Gourlay-Francé, Colloque Chimie et expertise - santé et environnement (2015)
(4) Zoom sur le saccharose : de la betterave au sucre, L. Amann, Mediachimie
(5) La chimie du vinaigre, R. Guelin, dossier pédagogique Mediachimie /Nathan
(6) La science et la technologie de l’alimentation vues par la chimie du bouillon, H. This, Colloque La chimie et l’alimentation (2010)
(7) Au menu de nos cousins : diversité, perception gustative et chimie des aliments des primates, S.Krief et Cl.-M. Hladik, Colloque La chimie et l’alimentation (2010)
La chimie n’arrête pas d’innover pour le bien de nos concitoyens en cette période de pandémie où les gestes barrières et le port du masque sont essentiels. Le manque de visibilité des visages apporté par les masques classiques en polyéthylène (1) est sur le point d’être contourné. Le professeur Vandensoep et son équipe de l’institut de Gand–Wevelgem, après plus de 12 mois de recherche, viennent enfin de publier des résultats sur un masque totalement transparent quasi invisible.
Après plusieurs essais sur des masques en polyéthylène multicouches directement issus de l’emballage alimentaire (2) on s’est aperçu que les couches filtraient bien l’oxygène mais pas l’azote et le gaz carbonique rejetés par les voies respiratoires, ce qui a failli entraîner des accidents heureusement sans grande gravité chez les volontaires testés. Ces essais malheureux ont cependant été très instructifs et ont conduit à l’élaboration de plusieurs prototypes.
Le masque est composé d’une mince feuille de polycarbonate percée de milliers de nano-trous et revêtue à l’extérieur d’une couche de polymères possédant une chaine perfluorée qui assure la « déperlance » (3) du masque. Ainsi l’air inspiré et les gaz expirés peuvent circuler mais les micro-gouttes des aérosols extérieurs, véhicules du virus, sont arrêtées et regroupées en macro-gouttes, tout en conservant la transparence du masque. Sa dénomination commerciale se ferait sous la marque Carat.
Le débit d’inspiration et d’expiration doit cependant faire face à une perte de charge due aux dimensions de nano-trous, c’est alors que l’équipe du professeur Vandensoep a eu l’idée de collaborer avec celle du professeur Trugludu de l’Université libre de Roubaix, spécialisée dans l’optique et notamment dans les micro-lasers. Ils ont alors augmenté les diamètres de micro-trous afin de diminuer la perte de charge et placé au-dessus des oreilles des micro-lasers (4) alimentés par des cellules photoélectriques disposées sur un serre-tête du porteur du masque qui balayent la partie avant du masque et font éclater toutes les gouttes des aérosols meurtriers. Sa dénomination commerciale est prévue sous le nom de Carré, compte tenu de sa forme plus anguleuse.
C’est alors, vu la complexité et surtout le coût de ce dernier masque, que l’idée de faire appel à des polymères autoréparables est venue à l’équipe, en utilisant des polymères à liaisons covalentes réversibles associant un réseau de type silicone et un autre réseau supramoléculaire (5). La mince feuille de polycarbonate est alors revêtue de cette couche autocicatrisante. Les trous de cette dernière pouvant être obturée par la simple chaleur de l’air expirée. L’équipe a alors donné à ce prototype le nom de « dArpone d» qui rappelle la base silicone, il demande encore à être testée pour la réversibilité des cycles.
Nul doute que d’ici peu les masques chirurgicaux difficiles à porter seront remplacés par ces masques qui permettront de mieux visualiser les visages et contribuer à la vie sociale. Souhaitons rapidement la fabrication des masques Carat, Carré et Arpone pour le bien-être et la sécurité de nos concitoyens.
Jean-Claude Bernier
1er avril 2021
Pour en savoir plus
(1) Oui la chimie avance masquée
(2) Chimie et maîtrise de la lumière
(3) Les textiles et les vêtements pour le sport
(4) La chimie à la lumière du laser : un intérêt réciproque
(5) Matériaux et chimie supramoléculaire (vidéo)
Les vagues de froid
Février 2021 a vu une météo très changeante et des vagues de froid vif en Europe du Nord et sur le continent américain. Des chutes importantes de température, accompagnées de chutes de neige abondantes, ont sévi en Scandinavie, au Canada et sur la côte Est des États-Unis. Plus surprenant un anticyclone arctique est descendu en Amérique au-delà de la Nouvelle-Angleterre et jusqu’au Texas. Des températures polaires de -19°C à -9°C et même -41°C dans le Minnesota ont été relevées alors même que neige et verglas paralysaient la circulation. Six états US ont déclaré l’état d’urgence grand froid et plus de 3 millions de foyers au Texas ont été privés d’électricité durant plus de 48 h (1) ainsi que d’eau courante pour plusieurs semaines, l’eau ayant gelé dans les canalisations.
En Europe, la Scandinavie a aussi été frappée d’une vague de froid qui a un peu débordé sur la France et le nord-est de l’Allemagne. La vertueuse Suède qui a remplacé ses centrales thermiques et nucléaires par des filières renouvelables (2) a vu tomber leur production électrique de 25% à 9%, les éoliennes étant gelées et les panneaux photovoltaïques enneigés. Pour échapper au black-out elle a remis en route la centrale au fioul et a eu recours à de l’électricité venue d’Allemagne, de Pologne et de Lituanie, las issue de centrales à charbon ! Les Suédois et Suédoises ont été invités par le gouvernement à réduire leur consommation, ce à quoi ils et elles ont répliqué par « #dammsugarupproret », soit « la révolte des aspirateurs ».
Les causes
On peut s’étonner que dans un État aussi riche en sources d’énergie qu’est le Texas, un black-out généralisé puisse arriver. Les hommes politiques ont été très interpellés à la suite de ces incidents qui ont tout de même fait plus d’une dizaine de morts. Certains ont pointé le pourcentage trop élevé de sources d’énergie intermittentes. La société privée de distribution ERCOT a fait l’objet de nombreuses critiques soulignant ses faibles investissements sur les lignes et le grand défaut du manque d’interconnexions avec les sources d’énergies d’autres États et au réseau national (3).
C’est là la grande différence avec l’Europe. Pour la France, une vague de froid fin 1978 avait provoqué une panne d’électricité générale le 19 décembre où les trois quarts du pays avaient été privés de courant durant une dizaine d’heures, alors que commençaient à produire les premières centrales nucléaires et que l’interconnexion des boucles de distribution était encore incomplète.
La leçon à cette date fut bien comprise. Il fut décidé d’accélérer le programme nucléaire et de parfaire une interconnexion européenne qui autorise les échanges de puissance électrique entre pays permettant de pallier des incidents locaux ou des conditions climatiques géographiques particulières. Il y a donc en Europe un marché d’échange du MWh qui, lors de la vague de février, est brutalement monté à 200 € au lieu de 30 €.
Les solutions
Au-delà de la toile d’araignée des interconnexions de grandes lignes de courant, il y a une réflexion sur notre avenir énergétique dans la perspective de la transition écologique. L’intermittent éolien et solaire n’est viable que s’il est soutenu par une source d’énergie constante (4) et modulable facilement suivant la demande et si possible non polluante. À ce sujet connaître la valeur en émission CO2 du KWh est cruciale (voir tableau ci-dessous).
| Filière | nucléaire | hydraulique | gaz | fioul | charbon |
| G CO2/kWh | 6 | 6 | 418 | 730 | 1060 |
Pour les producteurs et régulateurs de réseau c’est un vrai casse-tête car comment ajuster en temps réel demande et production et comment faire face à des conditions extrêmes - froid intense, neige et glace et anticyclone permanent - sans vent durant plusieurs jours (5) ? Les centrales thermiques à gaz ou fioul peuvent répondre assez vite mais comme elles ne fonctionnent que quelques jours par an, leur kWh est cher et peu d‘investisseurs sont enclins à s’y intéresser. De plus leur bilan carbone n’est pas bon. En France l’hydraulique peut répondre assez vite à ces hausses de demande. Pour le nucléaire, actuellement le CEA et EDF planchent sur un procédé de variation rapide de 20% à 80% de la puissance d’un réacteur en moins d’une heure (6). Par ailleurs la recherche et quelques réalisations de SMR (petits réacteurs modulaires) vont permettre de diversifier les applications nucléaires de puissance comprises entre 100 et 300 MW et répondre à ces types de demandes (7). Le projet français « Nuward » vient de bénéficier financièrement du plan de relance. Il regroupe le CEA, EDF, TechnicAtome et Naval Group. Avec deux ilots de 170 MW et une seule salle de commande, il sera le plus compact du marché dans une cuve de 4 m de diamètre et de 13,5 m de hauteur dans un bâtiment semi enterré associé à un système de refroidissement passif (sans pompes) garantissant une sureté et une protection de qualité. Modèle le plus compact issu de notre expérience de la propulsion navale, il pourrait être commercialisé en 2035 avec une chaine de fabrication modulaire et standardisée permettant des coûts réduits. Il ne faut pas tarder, car selon l’OCDE/AEN le marché des SMR à cet horizon peut être de 20 GW. Déjà la Russie a installé un SMR sur barge flottante en Sibérie et aux États-Unis la société NuScale prévoit d’installer un premier module en Utah en 2023.
Sur le papier nos gouvernants et l’opinion publique pensent qu’il est simple d’élaborer une transformation énergétique radicale de la société, sur le terrain c’est une autre affaire… (8)
Jean-Claude Bernier
Mars 2021
Pour en savoir plus :
(1) Noël aux tisons ? editorial Jean-Claude Bernier
(2) Une électricité 100% renouvelable : rêve ou réalité ? fiche Chimie et… en fiches
(3) Réseaux de transport de l’électricité et transition énergétique, article et conférence de S. Henry (colloque Chimie et enjeux énergétiques, 2012)
(4) Le challenge de l’électricité verte, collection Chimie et Junior
(5) La complexité du réseau et l’électricité verte, article et conférence de Y. Bréchet (colloque Chimie et enjeux climatiques, 2015)
(6) Équipe de recherche (vidéo du CEA)
(7) Le nucléaire de fission dans le futur. Complémentarité avec les renouvelables, conférence de C. Behar (colloque Chimie et énergies nouvelles, 2021)
(8) Vitesse de déploiement et acceptabilité des nouvelles technologies dans le domaine des énergies, conférence de G. de Temmerman (colloque Chimie et énergies nouvelles, 2021)
Image d'illustration : K. et B. Emerson - Flickr
licence Creative Commons Attribution 2.0 Générique.
Mediachimie sera présente à l’édition virtuelle du Village de la Chimie, le 12 mars 2021 (zone 1).
De 11h15 à 12h00, ne ratez pas la conférence de Françoise Brénon et Freddy Minc (Mediachimie) :
« La chimie offre une grande diversité de métiers riches d’avenir ». Découvrez les formations et les métiers qui embauchent à l’aide du site mediachimie.org
Inscrivez-vous pour assister aux conférences et démonstrations en live. Le programme est ici.
 Pour Mediachimie : rendez-vous en zone 1 - stand en bas à droite.
Pour Mediachimie : rendez-vous en zone 1 - stand en bas à droite.
Nous répondrons à vos questions en live.
Des ateliers (vidéos, témoignages…) en replay seront également diffusés. Voir le planning ici.
Pour ceux qui ne peuvent se connecter en direct le 12 mars, revivez la journée du vendredi en replay le samedi 13 mars !
Des conférences, des démonstrations, des ateliers et un escape Chimie seront disponibles. Vous pourrez également vous rendre sur les stands entreprises et établissement de formation et y retrouvez toute leur documentation.
L’UNAFIC (Union Nationale des Associations Françaises d’Ingénieurs Chimistes) et la Fondation de la Maison de la Chimie vous invitent à participer au webinaire sur le thème « Synthèse des principes actifs : une stratégie de relocalisation en France par l’innovation ». Plus d’information et participation gratuite selon les informations de l’invitation.
Vous pouvez assister en différé au Colloque Chimie et Énergies Nouvelles sur Youtube.
Les vidéos sont également disponibles et téléchargeables, conférence par conférence, sur cette page dédiée.
Session du matin
Session 1 de l'après-midi
Session 2 de l'après-midi
ll y a urgence que le système mondial de production, distribution et consommation d’énergie soit engagé sur une trajectoire dont les effets seront déterminants pour l’avenir de la planète et celui de ses habitants en limitant ses effets sur le climat : le sujet est plus que jamais au coeur des préoccupations de la Société, notamment de la recherche et de l’industrie. Malgré l’engagement politique des États et la progression des énergies dites « vertes », notamment du solaire électrique ou thermique et de l’éolien offshore pour lesquels on s’attend à des facteurs de croissance record dans les prochaines décennies, toutes les énergies flexibles, propres, abondantes, décarbonnées seront nécessaires pour faire face aux besoins toujours croissants de la demande en énergie. Pour cela il est urgent d’innover, mais aussi d’optimiser les technologies existantes en lien avec l’objectif d’un développement durable garantissant l’accès de tous à des services énergétiques fiables à des coûts abordables.
Nous avons souhaité dans ce 25e colloque « Chimie et… » faire un point scientifique objectif sur une évolution possible du « bouquet énergétique diversifié » en cours de développement.
Les conférenciers ont été choisis parmi les experts les plus qualifiés dans les différents domaines concernés, la recherche, l’industrie, la politique et l’économie.
Le niveau se veut accessible à tous pour permettre un large débat.
Bernard Bigot
Président de la Fondation internationale de la Maison de la Chimie
et Directeur Général de l’Organisation internationale ITER
Ce début février est marqué par le retour de températures hivernales classiques et négatives. C’est alors une floraison dans tous les journaux papiers ou télévisés d’une série de reportages et conseils plus ou moins pertinents liés à ces basses températures. Pourquoi Mediachimie ne s’y mettrait pas avant que le mercure ne remonte !
Chez vous
Pour un bon cocooning, vérifiez bien que l’isolation de votre maison est bonne. C’est d’abord 15 à 20 cm de laine de verre ou de cellulose dans vos combles qui vous font économiser 30% sur la fuite des calories (1). Les vitrages à haute isolation de vos baies vitrées et fenêtres avec deux lames de verre sodo-calciques séparées par un volume d’argon et disposant sur l’une des faces intérieures d’un micro-revêtement métallique renvoient les infrarouges vers l’intérieur et évitent de chauffer le jardin (2). Si vous avez un chauffage électrique vos murs sont équipés de contrecloisons en plâtre munies d’une bonne épaisseur de polystyrène. Pensez aux radiateurs à accumulateurs de chaleur qui, équipés d’une âme de céramique (silico-aluminates de calcium) chauffée la nuit, restituent ses calories le jour. Grâce à la chimie des matériaux vous économisez les kWh tarif nuit.
En voiture
Attention, au démarrage n’oubliez pas que votre bonne vieille batterie au plomb perd 33 % de sa puissance lorsqu’on atteint –5°C (3). Si vous roulez au diesel vérifiez bien que vous avez fait le plein à la pompe avec le gas-oil hiver qui a un point de cristallisation à –15°C et qu’il ne vous reste plus du gas-oil été (qui cristallise à 0°C), bien que pour des raisons commerciales il semble que certaines marques fournissent un carburant unique été – hiver. Si vous roulez à l’éthanol (E 85) le démarrage à froid est parfois plus difficile car les vapeurs d’alcool sont moins inflammables. Les pétroliers diminuent en hiver la proportion d’éthanol qui peut descendre à 60% eu lieu de 85% en été (4).
Assurez-vous que le liquide de refroidissement (souvent appelé antigel) de votre moteur est bien adapté à l’hiver afin qu’il ne gèle pas dans votre réservoir. Mélanges d’eau, d’éthylène glycol ou de propylène glycol et d’additifs, ils peuvent supporter sans geler des températures pouvant descendre à –25°C ou moins selon les proportions (5).
Si la route est glissante à cause du verglas, heureusement les municipalités et la DDE ont salé les revêtements (6). Mais roulez avec des pneus hiver qui ont une gomme tendre à base de caoutchouc naturel et de mélanges butadiène / acrylonitrile. En effet suivant la composition la température de transition vitreuse est abaissée et par temps froid le pneu reste souple procurant une meilleure tenue de route (7).
Si le matin vous déneigez carrosserie et pare-brise, utilisez une raclette en polystyrène ou polypropylène moins dure que le verre ou le vernis de peinture pour ne pas faire de rayures. Pour la couche de glace sur le pare-brise, une « pulvérisette » d’alcool ménager vaut mieux que l’eau chaude car le mélange eau – alcool se solidifie à bien plus basse température que 0°C. Enfin si les montants de portes ont leurs joints caoutchouc collés, pensez à les enduire d’une fine couche d’éthylène glycol qui tiendra jusque –45°.
À pied dehors
En promenade ou pour faire vos courses n’hésitez pas à vous couvrir en multicouches (8) :
- des sous-vêtements en microfibres très légers, des maillots en fibres creuses qui vont emprisonner de l’air qui est un isolant thermique efficace pour protéger du froid ;
- un « pull polaire » en fibres polyesters aérées qui viennent en partie du recyclage des bouteilles plastiques en PET ;
- une veste en textile imper respirant, imperméable à la pluie ou la neige mais laissant passer la transpiration, obtenu après enduction de polyuréthane ou des membranes hydrophobes comme les polyfluorothylène (9) ;
- ou mieux encore des textiles thermorégulants à changement de phase où sont encapsulées sur les fibres des cires qui se liquéfient à plus de 37°C lorsque vous êtes dans une pièce chauffée et qui, quand vous sortez à l’extérieur au froid, se solidifient en libérant de la chaleur.
On trouve aussi des vêtements et gants pour motards ou artisans du BTP avec des microcircuits de résistances alimentées par des piles ion-lithium qui sur commande peuvent chauffer soit les mains, soit le dos.
En cette période de COVID, vous sortez avec les masques sanitaires en polypropylène qui comportent une couche de « meltblown », microfibres qui par attraction électrostatique captent les nano-gouttes des aérosols pouvant véhiculer le virus (10). Si les masques sont humides les fibres ne servent plus de barrière, donc éviter de les mouiller par la respiration en hiver ou sous la pluie ou la neige. L’Académie de médecine canadienne recommande par grand froid de porter au-dessus une écharpe.
Mais que cela ne vous empêche pas de soigner votre visage et votre peau : par grand froid sec, elle souffre, alors n’oubliez pas les crèmes hydratantes et les rouges à lèvres protecteurs (11).
Parés pour le grand Nord ?
Jean-Claude Bernier
Février 2021
Pour en savoir plus
(1) Isolation dans l’habitat : la chimie pour ne pas gaspiller de calories !
(2) Les vitrages : laissez entre la lumière
(3) Applications présentes et futures des batteries
(4) Pourquoi met-on de l’alcool dans l’essence ? (Question du mois)
(5) Glycol / Éthane-1,2-diol / Éthylène glycol (Produit du Jour Société Chimique de France)
(6) Pourquoi met-on du sel sur les routes lorsqu’il gèle ? (Question du mois)
(7) Le pneumatique : innovation et haute technologie pour faire progresser la mobilité
(8) Vers des textiles intelligents pour des vêtements performants et innovants
(9) Les textiles imper-respirants
(10) Oui la chimie avance masquée
(11) La peau au quotidien : protection et embellissement
Hum ! Un beau gâteau bien gonflé ! Les recettes des cakes, quatre-quarts, madeleines, cookies… nécessitent de la levure dite « chimique ». De quoi s’agit-il et à quoi sert-elle ?
Tout d’abord le mot « levure chimique » est utilisé pour se différencier de la « levure de boulanger » dont l’action est due à des microorganismes.
Pourquoi ajouter de la levure chimique ?
L’objectif de la levure chimique est de libérer un gaz lors de la cuisson afin de faire gonfler la pâte du gâteau. C’est ainsi que ces sachets sont aussi surnommés « poudre à lever » ou « poudre levante ». Dans la pratique ce gaz est le dioxyde de carbone (ou gaz carbonique), CO2. Il est obtenu par une réaction acidobasique une fois que la levure est mélangée aux ingrédients et humidifiée.
Que contiennent les sachets de levure chimique ?
Citons quelques compositions indiquées. Vous reconnaitrez sans doute celle que vous avez achetée :
- diphosphate disodique, carbonate acide de sodium, amidon de blé ;
- pyrophosphate disodique, bicarbonate de sodium, amidon de blé ;
- diphosphate disodique, bicarbonate de soude, amidon de maïs ;
- diphosphtates et carbonates de sodium, farine de blé ;
- pyrophosphate de sodium, bicarbonate de sodium, farine de froment (ancienne formule) ;
- acide tartrique, bicarbonate de soude, fécule de maïs (ancienne formule) ;
- crème de tartre, carbonate acide de sodium, fécule (ancienne formule).
À première vue ces compositions semblent différentes. Regardons de plus près.
Le bicarbonate de sodium, le carbonate acide de sodium et le bicarbonate de soude sont en réalité le même composé chimique dont le nom précis est l’hydrogénocarbonate de sodium et qui a pour formule chimique NaHCO3 (ou Na+, HCO3-) (i). C’est l’ingrédient commun indispensable. C’est lui qui permettra de libérer le dioxyde de carbone en jouant un rôle de base.
Les termes diphosphate disodique et pyrophosphate disodique concernent le même composé de formule Na2H2P2O7 (ii). L’acide tartrique a pour formule C4H6O6 (iii) et la crème de tartre KC4H5O6. Ce sont tous les trois des composés au comportement acide en présence d’eau.
La farine de froment, l’amidon de blé ou la fécule ou l’amidon de maïs contiennent tous de l’amidon [1]. Il est nécessaire à la conservation ou stabilisation du produit avant usage en limitant la réaction chimique entre les deux autres constituants et en absorbant l’humidité. Il est donc très important que le sachet soit conservé au sec.
Lors de la réalisation de la recette, il est aussi nécessaire de mélanger à sec la levure à la farine avant l’ajout des ingrédients humides.
L’ajout d’eau
Quelle que soit la recette, l’ajout d’eau est indispensable. Elle est apportée soit avec les œufs (l’eau représente 75% de la masse d’un œuf), soit avec un jus de fruit, du lait, ou tout simplement de l’eau seule…) . Elle dissout les acides et les bases contenus dans la levure, facilite le malaxage des ingrédients et la mise en contact des réactifs.
Le gonflement : quelles réactions ?
Une réaction entre acide et base
Une fois tous les ingrédients de la recette bien mélangés, les acides présents échangent un proton H+ avec le bicarbonate selon, par exemple :
H2P2O72- + HCO3- → CO2 (gaz) + H2O + HP2O73-
Cette réaction commence faiblement dès le mélange à froid puis à la chaleur du four, le dégagement de CO2 s’accentue et s’accélère.
En effet cette réaction est équilibrée avec une constante d’équilibre proche de 1. Le chauffage est favorable au dégazage de CO2 ce qui déplace l'équilibre jusqu’à la consommation totale du bicarbonate. Ainsi la pâte lève ; il se crée des alvéoles. Puis la pâte alvéolée se solidifie en gardant sa forme. Voilà c’est réussi !
Le composé secondaire formé HP2O73- est à la fois un acide et une base et seul dilué donnerait un pH voisin 7,3, soit un pH quasiment neutre. S’il reste du réactif initial H2P2O72- le pH serait alors légèrement inférieur à 7.
Pourrait-on utiliser du bicarbonate seul ?
C’est envisageable car il participe à l’équilibre 2 HCO3- = CO2 (gaz) + CO32- + H2O qui montre une formation possible de dioxyde de carbone et de carbonate. Toutefois le dégagement est quasi nul à froid, l’équilibre étant en faveur de HCO3- et ne se fait que lentement et de façon moindre à partir de 70 °C.
Le gâteau peut se solidifier avant que la pâte soit totalement levée. De plus l’ion carbonate CO32- formé en parallèle donne un milieu très basique au goût peu agréable.
Et le jus de citron ?
Quand l’eau est ajoutée sous forme de jus de citron (cake au citron, par exemple) cela introduit de l’acide citrique (iv) qui participe notablement à l’augmentation du dégazage. Il n’est en général pas totalement consommé ce qui donne ce petit goût acide caractéristique de cette pâtisserie. Mais ce n’est pas son seul rôle : il influence le caractère viscoélastique de la pâte à base de farine.
Que faire si on est en panne de levure chimique ?
Vous pouvez utiliser du bicarbonate de sodium et ajouter un peu de jus de citron.
Effervescence et analogie
On peut noter que toutes sortes de produits effervescents (dont des médicaments) présentent les mélanges bicarbonate et acide citrique ou bicarbonate et dihydrogénophosphate donnant du CO2 dès l’ajout d’eau.
Historiquement
Aux États Unis, c’est dans les années 1840 qu’apparait dans un livre de cuisine la proposition d’ajouter aux ingrédients d’une pâte de gâteau du bicarbonate de sodium et de la crème de tartre. Puis de nombreux essais ont été réalisés, y compris en Europe, pour sélectionner l’acide à ajouter avec le bicarbonate, la source d’amidon et les bonnes proportions. Les industriels ont alors vendu des mélanges prêts à l’emploi, aux proportions jalousement gardées.
Et le bicarbonate de sodium, matière première indispensable
Composé connu depuis l’Antiquité à l’état naturel, c’est le Français N. Leblanc qui a mis au point le premier procédé de fabrication à la fin du XVIIIe siècle [2], plus tard supplanté par le procédé Solvay [3]. Le premier producteur mondial est encore Solvay. Il existe des gisements naturels conséquents de bicarbonate aux États-Unis.
Le bicarbonate a de très nombreuses autres applications [3] [4].
Allez, à vos recettes !
Et n’oubliez pas de bien respecter les proportions. Les sachets vendus contiennent en général 10 g de levure à mélanger dans 500 g de farine. Un défaut de levure et le gâteau n’est pas levé, un excès de levure et le gâteau ne lèvera pas plus mais aura au final un arrière-gout de levure.
Françoise Brénon
(i) Cet additif alimentaire a pour code E500. Il est appelé baking soda dans les recettes américaines. Dans une des compositions lues sur les sachets, le terme « carbonates » avec un s (donc pluriel) est imprécis et fait penser à un mélange de carbonate ( CO32-) et d’hydrogénocarbonate. Ces composés appartiennent aux couples acides-bases CO2, H2O / HCO3- / CO32- dont les pKa sont 6,35 et 10,3 et jouent un rôle similaire.
(ii) Il s’agit du dihydrogénopyrophosphate disodique, codé E450i.
Le nom pyrophosphate de sodium indiqué sur un des sachets est imprécis. On pourrait penser à Na4P2O7 dont le nom précis est pyrophosphate tétrasodique. Mais celui-ci est une base ne pouvant donc réagir avec le bicarbonate pour donner du CO2. En réalité à l’analyse le produit contient aussi le E450i, soit H2P2O72-, comme dans les autres sachets. Les couples acidobasiques relatifs à l’acide pyrophosphorique sont : H4P2O7 / H2P2O7- / H2P2O72- / HP2O73- / P2O74- et les pKa correspondants sont 1,0; 2,5 ; 6,1 ; 8,5 (source « Les Réactions chimiques en solution », G. Charlot, chez Masson)
(iii) Ce diacide de formule semi-développée HOOC-CHOH-CHOH-COOH a pour nom précis l’acide 2,3-dihydroxybutanedioïque dont les pKa sont 3,0 et 4,4. Son code est le E334.
KC4H5O6 correspond au monoacide K+, -OOC-CHOH-CHOH-COOH.
Attention le mot courant « tartre » qui correspond au calcaire (CaCO3) qui se dépose sur les canalisations ou les bouilloires n’a aucun lien avec l’acide tartrique. Le nom « crème de tartre » provient des dépôts de tartrate sur les cuves en fin de processus de vinification.
(iv) L’acide citrique de formule HOOC-CH2-C(OH)COOH-CH2-COOH est un triacide de pKa 3,0 ; 4,4 ; et 5,7. Sa 1ère acidité est plus forte que celle de H2P2O72- et sa réaction sur HCO3- est totale.
Pour en savoir plus
[1] Zoom sur l’amidon sur le Site Mediachimie
[2] Bicarbonate de sodium - produit du jour (sur le site de la Société Chimique de France)
[3] Hydrogénocarbonate de sodium sur le site L’Élémentarium : propriétés, fabrication industrielle, applications
[4] le bicarbonate Solvay® (PDF) sur le site de Solvay
Mediachimie.org vous propose de retrouver sur cette page un ensemble de ressources et de liens relatifs au coronavirus SARS-CoV-2 et à la pandémie de COVID-19.
Éditoriaux Mediachimie
- De la conception à l’injection des vaccins : un vrai défi logistique
- Un vaccin, oui, mais quel vaccin ?
- Oui la chimie avance masquée
- Gel hydroalcoolique : pourquoi il faut l’utiliser avec modération et de façon circonstanciée
- Le coronavirus un défi pour la chimie du vivant
Zoom sur
Question du mois
Articles de L'Actualité chimique
- Covid-19, ou quand le manque d’antiviraux efficaces devient un problème mondial
- Covid-19 : la chimie médicinale à l’assaut des mécanismes de propagation virale
- La cytosine, au cœur de l’immunité antivirale innée
- Covid-19 et désinfection : du bon usage de l’eau de Javel
Académie des sciences
- Vidéo de la séance exceptionnelle organisée le 7 mai 2020 par l'Académie des sciences sur la maladie à coronavirus Covid-19
- Questions scientifiques sur la maladie à coronavirus COVID-19 avec des fiches explicatives expert et grand public
Autres ressources
- Tribune du journal Les Echos : Où sont les antiviraux ?
Dans cet article paru dans "Les Echos" vendredi 27 mars 2020, le professeur Bernard Meunier, membre du Conseil de la fondation de la Maison de la Chimie et ancien président de l'Académie des sciences analyse en tant que spécialiste reconnu internationalement de la biochimie les possibilités de trouver un remède au COVID-19, mais surtout il examine de façon critique la politique de santé et la stratégie de recherche pharmaceutique qui ont négligé le plus souvent les avancées et les potentiels des "petites molécules" chimiques.Lire l’article de Bernard Meunier sur le site des Echos | Version PDF
- Article de Pour la Science : Comment fonctionnent les masques de protection respiratoire
- Lettre d’encouragement et de reconnaissance à la filière « Chimie et Matériaux » pour leur rôle dans la lutte contre la propagation du COVID 19, Bruno Lemaire, Ministre de l’Economie et des Finances de 23 mars 2020
#Coronavirus : @BrunoLeMaire écrit aux entreprises de la Chimie et à leurs salariés, "maillon essentiel de la chaîne d'approvisionnement", pour leur exprimer sa reconnaissance et les encourager pic.twitter.com/OFbCc69mvX
— France Chimie (@FranceChimie) March 24, 2020
La situation actuelle
Il existe en France huit raffineries du pétrole, de la Normandie à la Méditerranée en passant par le sud de Lyon. La grande majorité du pétrole raffiné sert à l’obtention des carburants, une autre partie fournit la matière première pour la chimie des dérivés du pétrole. Ainsi ces sites sont aussi des complexes de pétrochimie.
La coupe pétrolière qui intéresse la chimie est essentiellement le « naphta » dont les chaines carbonées vont de 5 à 10 atomes de carbone. Celle-ci subit l’hydrocracking (ou craquage à la vapeur d’eau) permettant d’obtenir les intermédiaires majeurs pour la chimie organique tels que les oléfines (éthylène (1), propène, butène, benzène…). Pour éviter la pollution due à la présence de soufre et d’azote dans le pétrole, des unités d’hydrodésulfuration (2) sont également présentes sur les sites.
Ces fabrications utilisent actuellement environ 13% du pétrole (3), part qui pourrait monter à 22% d’ici 2050 sans régulation. Les politiques de transition énergétique vont limiter les objets en plastique, faire baisser la demande énergétique des bâtiments, économiser la consommation des véhicules en carburants, voire passer aux véhicules électriques, et donc baisser les volumes consommés de gas-oil et d’essence. C’est ainsi que les capacités de raffinage en France et en Europe n’ont cessé de diminuer. Les capacités de raffinage en Europe représentaient en 2008 21% des capacités mondiales et elles ne sont plus que de 17% en 2020. La consommation des produits pétroliers (carburants compris) dans l’hexagone a suivi la même pente, 98 millions de tonnes (Mt) en 1998, 89 Mt en 2000 et 73 Mt en 2019 qui plombent cependant encore notre balance commerciale de quelques dizaines de milliards d’euros.
L’évolution due aux huiles de schiste
Il faut se rappeler que la stratégie des grandes compagnies pétrolières a évolué dans les années 2010 avec l’arrivée de l’huile et du gaz de schiste américain sur le marché mondial. Historiquement les pétroliers européens utilisaient la coupe « naphta » pour la production de l’éthylène intermédiaire essentiel pour la chaine de valeur en chimie organique notamment pour les polymères résines et plastiques (4). Pour ce faire il faut casser les chaines carbonées des hydrocarbures du naphta à l’aide des vapocraqueurs qui malheureusement en Europe avaient plus de 25 ans. Aux États-Unis de nouveaux vapocraqueurs à base éthane produit en abondance par les gaz de schiste ont abaissé le prix de l’éthylène d’un facteur 2 à 3 ! Pour ne pas « mourir » les Européens ont investi soit dans de nouveaux vapocraqueurs en Écosse et en Norvège, soit dans la modernisation d’anciens vapocraqueurs au sein de plateformes chimiques pour leur donner plus de flexibilité. Fournir l’éthylène, le butadiène et des aromatiques sur place limite les émissions et les besoins logistiques. C’est ainsi que TOTAL a investi à Gonfreville et à Anvers, de même INEOS à Anvers. Ces deux acteurs majeurs européens comme ExxonMobil (USA) souffrent de la crise de 2020 qui a non seulement entrainé une chute de la vente des carburants mais aussi de produits chimiques et de matières plastiques pour l’automobile. Tout en proclamant que le pétrole n’a pas dit son dernier mot notamment en Chine, aux USA et dans les pays émergents, il se prépare des stratégies à long terme dans le ton européen de la transition énergétique en « verdissant l’or noir ».
Vers le « zéro carbone » ?
INEOS lance ainsi à Anvers le « Project One » d’un vapocraqueur base éthane qui devrait produire 1,5 Mt d’éthylène, le plus important en Europe et le plus économe, avec d’une part la récupération d’hydrogène dévolu à la mobilité et d’autre part un contrat avec ENGIE qui doit lui apporter toute l’énergie électrique éolienne pour son futur complexe. Pour la France on se rappelle la reconversion de la raffinerie de La Mède condamnée à la fermeture et transformée en bioraffinerie avec un investissement de plus de 275 millions d’euros devant produire des agrocarburants avec le procédé HVO (Hydrotreated Vegetable Oil), un procédé français. Cette unité traite en partie de l’huile de palme, ce qui a soulevé diverses réactions (5). TOTAL annonce en 2020 la transformation de la raffinerie de Grandpuits (77) en investissant 500 millions d’euros dans une plateforme « zéro pétrole » afin de fournir 400 000 t/an de biocarburants majoritairement destinés au secteur aérien, à partir de graisses animales, huiles de cuisson usagées et végétales recueillies régionalement. Sur le même site, associé au néerlandais Corbion, il veut produire du bioplastique centré sur le PLA (6) et développer une unité de recyclage de plastique par pyrolyse.
Après avoir fermé le vapocraqueur sur le site de Carling (57), TOTAL, après l’acquisition de Synova, veut devenir un acteur majeur dans le recyclage chimique des plastiques. Sur ce site pétrochimique, l’association Chemesis (Total, Arkema, Air Liquide, etc.) promeut la chimie verte avec Metex Noovista qui produit du propanediol et de l’acide butyrique biosourcés, et Afyren synthétise des molécules pour l’alimentation et des conservateurs aromatiques à partir de sous-produits de betterave. Et, dernier venu, Circa Sustainable Chemicals produira à partir de coproduits du bois 1000 t/an de Cyrène, un solvant fluide biosourcé (encres) (7). C’est ainsi qu’à proximité de l’Allemagne se transforme un site de chimie performant compatible avec les exigences environnementales, et générateur d’emplois dans le Grand-Est (8).
Les nouveaux marchands d’énergies
L’annonce de la nouvelle stratégie des pétroliers est celle de devenir, comme le dit Total, une entreprise de « multi-énergies ». Plusieurs facettes apparaissent dans ces stratégies : donner une plus grande part au gaz liquéfié (GNL, constitué majoritairement de méthane) et une nouvelle part à l’électricité à partir des renouvelables. Après l’expérience décevante de SunPower c’est entre 2 et 3 milliards d’euros par an qui seront consacrés à la production et au stockage d’électricité bas-carbone jusqu’en 2030. Pour cela TOTAL a racheté SAFT pour les batteries de stockage et s'allie à Peugeot et à Michelin pour le projet d’une giga factory en France de production de batteries ions-lithium. Les ventes de Total se répartiront alors entre 30% de produits pétroliers et 5% de biocarburants, 15% pour l’électricité bas carbone et 50% pour les gaz dont l’hydrogène. Le défi est lancé entre Shell, BP, Exxon et d’autres : ce sera à qui s’imposera pour la capture du CO2, les énergies propres et l’hydrogène vert ? (9) Ce qui est sûr cependant, c’est qu’à moins d’une catastrophe mondiale, la demande d’énergie ne va pas se tarir d’ici 2050.
Jean-Claude Bernier et Françoise Brénon
Janvier 2021
Pour en savoir plus
(1)° Éthylène, fabrication industrielle (site l'Élémentarium)
(2) Comment assainir l’atmosphère des villes ? L’hydrotraitement (Réaction un clin d'oeil)
(3) L’extraction du pétrole et du gaz (vidéo CEA)
(4) L’Union des industries chimiques (UIC) tire la sonnette d’alarme
(5) Polémiques dans le monde des biocarburants
(6) Zoom sur l'amidon : de l’amidon aux polymères biosourcés
(7) Les solvants biosourcés : opportunités et limitations
(8) Pour une industrie chimique propre et durable (Chimie et…junior)
(9) Qu’est-ce que l’hydrogène vert ?
Illustration : Raffinerie de Port-Jérôme-Gravenchon, Wikimedia, Gérard-travail personnel, CC BY-SA 4.0
ll y a urgence que le système mondial de production, distribution et consommation d’énergie soit engagé sur une trajectoire dont les effets seront déterminants pour l’avenir de la planète et celui de ses habitants en limitant ses effets sur le climat : le sujet est plus que jamais au coeur des préoccupations de la Société, notamment de la recherche et de l’industrie. Malgré l’engagement politique des États et la progression des énergies dites « vertes », notamment du solaire électrique ou thermique et de l’éolien offshore pour lesquels on s’attend à des facteurs de croissance record dans les prochaines décennies, toutes les énergies flexibles, propres, abondantes, décarbonnées seront nécessaires pour faire face aux besoins toujours croissants de la demande en énergie. Pour cela il est urgent d’innover, mais aussi d’optimiser les technologies existantes en lien avec l’objectif d’un développement durable garantissant l’accès de tous à des services énergétiques fiables à des coûts abordables.
Nous avons souhaité dans ce 25e colloque « Chimie et… » faire un point scientifique objectif sur une évolution possible du « bouquet énergétique diversifié » en cours de développement.
Les conférenciers ont été choisis parmi les experts les plus qualifiés dans les différents domaines concernés, la recherche, l’industrie, la politique et l’économie.
Le niveau se veut accessible à tous pour permettre un large débat.
Bernard Bigot
Président de la Fondation internationale de la Maison de la Chimie
et Directeur Général de l’Organisation internationale ITER
[Ajout février 2021] Le colloque a été diffusé en direct sur la chaine Youtube de Mediachimieet est disponible au même endroit en différé.
En cette fin d’année l’expression « ça sent le sapin » doit perdre son sens argotique pessimiste et plutôt se compléter par « ça sent bon le sapin de Noël ». À l’approche du 25 décembre 2020 nous avons besoin d’une bouffée d’optimisme et, même si nous sommes déconfinés ou confinés, le sapin traditionnel dans le salon va agir comme une douce thérapie.
Nous l’avons acheté « bio », ou même « loué » si nous sommes d’abord écologistes, puis décoré avec nos guirlandes aluminisées et celles parsemées de LED multicolores.
 Nous avons ainsi déjà profité de ses odeurs fraiches et boisées (1). Le pin sylvestre dégage plus de 44 composés olfactifs (2). Le principal responsable est la pinène (C10H16), présente sous ses deux formes isomères α et β. L’α-pinène présente dans l’essence de térébenthine est aussi connue comme antiseptique présente aussi dans la sauge. L’autre odeur fraiche du sapin est celle de l’acétate de bornyle à l’odeur de résine fraîche, utilisé aussi dans les parfums ou les désodorisants. Synthétisé par plusieurs conifères il est aussi utilisé en phytothérapie pour ses propriétés sédatives (3).
Nous avons ainsi déjà profité de ses odeurs fraiches et boisées (1). Le pin sylvestre dégage plus de 44 composés olfactifs (2). Le principal responsable est la pinène (C10H16), présente sous ses deux formes isomères α et β. L’α-pinène présente dans l’essence de térébenthine est aussi connue comme antiseptique présente aussi dans la sauge. L’autre odeur fraiche du sapin est celle de l’acétate de bornyle à l’odeur de résine fraîche, utilisé aussi dans les parfums ou les désodorisants. Synthétisé par plusieurs conifères il est aussi utilisé en phytothérapie pour ses propriétés sédatives (3).

Mais il n’y a pas que le sapin et ses parfums pour vous réconforter en cette période de Noël. Il y a bien sûr l’odeur du chocolat chaud qui contient des polyphénols excellents pour l’organisme mais aussi des endorphines stimulantes et euphorisantes idéales en hiver (5).
Ainsi le pain d’épices avec le gingérol du gingembre, mais aussi sa saveur douce, sucrée et légèrement épicée et due à la zingérone qui s’est développée durant la cuisson.
Si vous aimez les marrons chauds, lorsqu’elles sont grillées les châtaignes dégagent quantité de composés volatils par réactions à haute température. La chaleur développe aussi diverses molécules dont le ? butyrolactone qui donne en bouche un léger gout sucré caramélisé ainsi que le furfural qui apporte le côté boisé avec une légère odeur d’amande (6).
Vous aurez aussi pour vous réchauffer un incontournable des marchés de Noël, hélas si peu nombreux cette année, le vin chaud. Même sans en abuser vous reconnaitrez son odeur avec les vapeurs d’alcool qui entrainent les parfums d’agrume, l’aldéhyde cinnamique et les phénols comme l’eugénol de la cannelle.
Voilà une thérapie simple et joyeuse pour les fêtes (7). Si vous n’avez pas de sapin, la chimie extractive peut vous fournir les huiles essentielles pour une aromathérapie. Vous avez le choix entre l’huile essentielle de coriandre, l’essence d’orange douce, ou les extractions de cannelle de Ceylan ou encore de sapin bouvier : alors à vos diffuseurs, mais attention comme dans tout traitement c’est la dose qui compte (8) !
Joyeuses fêtes.
Jean-Claude Bernier
Décembre 2020
Pour en savoir plus :
(1) Quand la chimie a du nez (vidéo)
(2) Les méthodes de mesure des odeurs : instrumentales et sensorielles
(3) Un exemple de production de substances actives : le pouvoir des plantes
(4) Zoom sur la chiralité et la synthèse asymétrique
(5) Les emplois thérapeutiques du chocolat
(6) Sucre et huile : des ingrédients clés pour la chimie biosourcée
(7) La nature pour inspirer le chimiste : substances naturelles, phytochimie et chimie médicinale
(8) La bonne chimie est-elle dans le bon dosage ?
Les bonnes nouvelles de novembre annonçant le début de la fin de l’épidémie du Covid-19 ont rempli d’espoir nos concitoyens qui lors du deuxième confinement ont plutôt le moral dans les chaussettes. Ce fut d’abord les laboratoires germano-américain Pfizer-BioNTech puis l’américain Moderna qui ont annoncé l’efficacité de leur vaccin respectivement à 90% et 94,5% à l’issue de données intermédiaires des essais de la phase 3. Il faut bien sûr attendre les rapports scientifiques complets des dossiers d’autorisation qui seront déposés à la Food and Drug Administration (FDA) aux États-Unis et à l’autorité sanitaire européenne qui doivent donner leur avis fin décembre. Ces deux vaccins sont composés de fragments d’ARN messager qui provoquent la synthèse de la protéine Spike qui induira une réponse immunitaire protégeant contre le Covid-19 (1). C’est apparemment la méthode d’approche scientifique (ARNm) la plus rapide mais à côté de ces deux laboratoires il y en a encore 9 dont on sait qu’ils ont déjà des résultats des essais de la phase 3 engagés sur plusieurs dizaines de milliers de volontaires : Johnson&Johnson – Janssen (vecteur viral), CanSino Biologics (Chine, vecteur viral), Sinopharm (Chine, virus inactivé), Gamaleya Research Institut (Russie, vecteur viral), Astra Zeneca (vecteur viral), Novavax (fragment d'antigène), Sinovac (Chine, virus inactivé), Bahrat Biotech (Inde, virus inactivé) (2).
Tous ont des essais cliniques importants dans de nombreux pays en particulier sur les soignants et les militaires dans les pays peu démocratiques. Par ailleurs Sanofi Pasteur avec GSK développe son vaccin en phase 3 (protéine recombinante) et Pasteur avec Themis (une autre protéine recombinante) serait en phase 2. La course au vaccin, avant même les autorisations de mise sur le marché, entraine des investissements énormes sur les chaines de fabrication et la logistique de l’acheminement des vaccins, car on parle ici non pas de millions de doses mais de milliards.
Prenons l’exemple des deux vaccins ARNm de Pfizer et Moderna, l’ARN est très instable et se dégrade rapidement à température ordinaire. C’est pourquoi on entrepose les molécules d’ARNm à basse température -80°C, elles baignent dans une solution aqueuse ionique enfermée dans des nanoparticules de lipides (capsules de gras) elles aussi sensibles à la chaleur. Pour éviter toute dégradation de l’efficacité du vaccin, Pfizer les conserve à -80°C et Moderna a su trouver une astuce pour ne les conserver qu’à -20°C.
Il faut donc de la fabrication à l’entrepôt du transport à la distribution aux hôpitaux ou pharmacies conserver la chaîne du froid. Si à -20°C les containers frigorifiques et les congélateurs dévolus à la conservation des matières alimentaires sont bien connus, à -80°C les ennuis commencent.
Les supercongélateurs (-80°C) sont pour l’instant des équipements de laboratoire avec des groupes frigorifiques qui fonctionnent avec le nouveau F-Gaz agréé en Europe. Plusieurs fabricants allemands dont Binder et un français Froilabo à Meyzieu près de Lyon peuvent livrer des armoires de 300 à 700 litres à des prix avoisinant 10 000 €, difficile cependant à équiper tous les hôpitaux et pharmacies d’ici le printemps 2021.
Il faut donc penser à des containers ou coffres isothermes qui pourront conserver à basse température durant plusieurs jours les doses de vaccins. Une entreprise spécialisée Olivo en France fabrique des armoires et conteneurs isothermes transportables fonctionnant avec deux types de réfrigérants :
- les cartouches en polyéthylène avec un gel eutectique. Ce sont, suivant les températures visées entre -21°C et -50°C, des solutions salines (3) avec NaCl (-21°) ou CaCl2 (-51°) pouvant contenir plusieurs centaine ou milliers de doses.
- à glace sèche. Les conteneurs comportent une certaine quantité de CO2 solide en neige ou en bâtonnets, on sait qu’à la pression atmosphérique il se sublime sans fondre à -78°C en absorbant pas mal de calories.
Ces containers sont isolés par plusieurs couches de polystyrène expansé avec des coefficients de qualité isotherme de 0,40W/(m2.K) qui permettent de maintenir plusieurs jours des températures aussi basses et pouvant aussi se recharger en CO2 solide. C’est une des solutions qui est retenue pour transporter par avion les millions de doses avec cependant une contrainte de sécurité pour la manipulation en zone de stockage et dans les avions, la ventilation nécessaire pour ne pas accumuler le gaz carbonique au-delà de 8% dans l’air pour les employés et pilotes.
Un aspect qui est aussi important est la mise sous flacon car il semble que l’on ne pourra distribuer les vaccins que sous forme multi-doses. C’est pourquoi les usines du verrier allemand Schott et de la filiale SGD Pharma de Saint-Gobain tournent à bloc pour l’intense fabrication de tubes et flacons en verres borosilicatés (type Pyrex bien connu des chimistes) (4) pouvant bien tenir aux variations de température. Encore faudra-t-il les remplir c’est ce que fera Delpharm en Eure-et-Loir qui vient d’investir plusieurs millions d’euros pour une chaine de remplissage stérile spécifique pour les paramètres de froid, capable de traiter plusieurs dizaines de millions de doses fournies par les deux sites de BioNTech en Allemagne.
Espérons que les autres vaccins en développement permettront d’être conservés entre -5°C et 0°C, ce qui simplifierait la fabrication, le transport et la distribution. Les chiffres annoncés par les laboratoires et les états qui frisent au total de 5 à 10 milliards de doses en flux tendus pour la population mondiale avec la mobilisation de plusieurs milliers de Boeing 747 et des centaines de millions d’emballages donnent le vertige. Pour Sanofi la production de l’antigène a déjà démarré à Vitry sur Seine en R&D. Les usines dans le Rhône, en Allemagne en Italie et aux États-Unis sont prêtes à démarrer sitôt la phase 3 terminée et les autorisations délivrées, les capacités seraient de l’ordre du milliard par an.
Alors qu’en France la campagne de vaccination dès 2021 est programmée, penchez-vous sur les coulisses du chemin abrupt du labo à l’aiguille sur votre bras. C’est assez fantastique, non ?
Jean-Claude Bernier
Décembre 2020
Pour en savoir plus :
(1) Zoom sur les vaccins
(2) Un vaccin, oui, mais quel vaccin ?
(3) Pourquoi met-on du sel sur les routes lorsqu’il gèle en hiver ?
(4) Comment faire des vitres avec du sable ? La réaction de fusion du verre
En plein hiver et particulièrement dans les régions très froides et montagneuses, il est nécessaire de lutter contre le manque d’adhérence des pneumatiques des véhicules sur sol gelé. On observe alors un ballet de saleuses, qu'on ne doit pas dépasser sur route. Mais que déversent-elles et pourquoi ?
Quels sont les effets du sel ?
.png)
Le sel ou chlorure de sodium de formule chimique NaCl, est soluble dans l’eau liquide. On appelle saumure le mélange liquide eau-sel. L’eau pure devient solide à 0°C sous la pression atmosphérique. Mais si l’eau est salée, ce mélange devient solide à une température inférieure à 0°C.
Ce phénomène est traduit par la courbe de congélation (ci-contre) qui indique la température pour laquelle l’eau devient de la glace, en fonction de la teneur (1) en sel dans le mélange. Comme le montre cette courbe, plus on ajoute de sel, plus la température de congélation baisse. Mais il y a une limite, repérée par le point E, nommé eutectique ! (2) Ainsi inutile de mettre plus de 23 g de sel pour 100 g de mélange, car les cristaux de sel ajoutés restent solides sans pour autant abaisser davantage le point de congélation. Donc ne gaspillons pas !
Et s’il fait une température inférieure à - 21°C, on a beau mettre du sel, la glace ne fond pas (3). Dans la pratique l’ajout de sel n’est plus efficace pour dissoudre la glace en dessous de -10°C, le phénomène de dissolution étant trop lent.
Les salages des routes
Les salages préventifs (la baisse de température est annoncée et imminente) se font pour empêcher l'eau de geler sur la chaussée, pour des températures entre -2° et -8°C.
Les salages curatifs (le verglas ou la neige sont déjà là !) se font avec un mélange de chlorures de sodium, de calcium (CaCl2) ou de magnésium (MgCl2), pour des températures inférieures à -8°C. En effet avec ces sels, les courbes de congélation des mélanges eau/sel de calcium ou magnésium ont des températures eutectiques plus basses (4).
L’épandage par une saumure liquide préalablement préparée, permet une diminution de la quantité de sel utilisée et son effet est beaucoup plus rapide. Il faut des saleuses adaptées.
En Amérique du Nord et au Canada, il est utilisé presque exclusivement du chlorure de calcium, compte tenu des températures hivernales très basses.
Les quantités de sel (NaCl) utilisées sont considérables
Elles varient selon les conditions météorologiques et selon qu’il s’agit d’un traitement préventif ou curatif : la fourchette va de 10 g à 15 g voire 20 g de sel par m². En France les quantités consommées sont de l'ordre 500 000 t à 1 Mt suivant les hivers plus ou moins froids.
Dans les agglomérations françaises, le sel représente l’essentiel des produits fondants utilisés (>99,5%). Environ 51% de la production mondiale de sel est consacrée à l'entretien des routes dans les pays froids. Le sel est actuellement le fondant de verglas le plus économique (environ 80 € la tonne).
Environnement
Ce sel engendre une pollution saline des bords de route, des eaux de surface, mais aussi des nappes phréatiques. Cela a un impact sur les sols, perturbe le système racinaire des plantes, bouscule les écosystèmes aquatiques (rivières et lacs) et favorise la corrosion de certaines infrastructures métalliques.
Différents produits alternatifs (majoritairement des composés organiques) sont recherchés et testés à la fois sur leur efficacité pour la viabilité des routes et sur leur impact environnemental (biodégradabilité, influence sur la demande biochimique en oxygène, …). Il faut aussi que leurs coûts restent compétitifs.
Par exemple, des formiates de sodium, HCOONa ou de potassium, HCOOK, déjà utilisés au Canada et en Finlande, sont très efficaces mais leur biodégradabilité reste un souci et ils sont respectivement 12 et 22 fois plus chers que le sel.
L’Estorob Bio D-Icer est une huile végétale à base de colza, déjà principalement utilisé dans les aéroports. Ce produit est à la fois biosourcé et biodégradable et s'avère 7 fois moins corrosif que le formiate de potassium et l'acétate de potassium. Il n'est pas corrosif vis-à-vis des métaux et freins carbone des avions. Mais il est aussi 11 fois plus cher que le sel (5).
De nombreuses autres études et essais pour des solutions plus écoresponsables sont réalisés de par le monde et la route de « cinquième génération » dotée de multiples fonctionnalités est à venir ! (6)
Françoise Brénon et l'équipe Question du mois
(1) Il s’agit plus précisément de la fraction massique, w, définie par :
w = masse du sel / masse du mélange eau-sel
(2) La lettre E pour Eutectique, qui signifie en grec « qui fond bien ». En effet l’abscisse du point E correspond à la fraction massique eutectique pour laquelle le mélange eau/sel a la température de fusion/congélation la plus basse, appelée température eutectique.
(3) En dessous de -21°C, selon les proportions en sel ajouté, il ne coexiste que des solides : eau solide (glace), NaCl solide ou solides en mélanges hétérogènes.
Dans la pratique on peut déverglacer un sol jusqu’à -30°C avec du chlorure de calcium ou du chlorure de magnésium car leurs températures eutectiques valent respectivement environ -51 °C et -33°C.
(5) On consultera avec intérêt l’étude sur la phytotoxicité de produits alternatifs au sel de déneigement (PDF) réalisée par l’ENSAIA et l’Université de Lorraine.
Voir Les infrastructures des transports : les apports de la chimie dans les projets d’avenir, Henri Van Damme (pages 34 et suivantes).