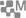L’impression 3D encore appelée couramment Fabrication Additive (FA) a quitté le domaine du prototypage dans les années 1980 pour gagner le domaine industriel et même le domaine ludique après les années 2000. Elle consiste à réaliser des pièces en 3 dimensions par ajouts successifs de couches de matières principalement des polymères ou des métaux. Elle s’oppose donc à la fabrication soustractive dont le principe est de retirer de la matière à une pièce préalablement moulée (1).
Elle présente de multiples avantages : elle repousse les limites de la technologie en réalisant des formes complexes jusqu’ici irréalisables par moulage ou forgeage, elle permet d’optimiser la quantité de matière première et donc de réduire les coûts et elle permet aussi de réduire les déchets.
Quels sont les procédés de Fabrications Additives ?
Le principe repose sur celui des imprimantes à jet d’encre que l’on retrouve dans tous les bureaux, sauf qu’ici on ne projette plus d’encre chargée en noir de carbone mais un polymère fondu ou une poudre métallique. De même, la buse de projection ne se promène plus de droite à gauche au-dessus du papier (2D), mais elle est animée d’un mouvement vertical au-dessus d’un plateau qui bouge horizontalement (3D).
- FDM (Fused Deposition Modelling) est le procédé le plus connu. L’imprimante est alimentée par un filament de moins d’un millimètre de diamètre d’un thermoplastique qui passe dans une buse chauffée à environ 150° à 250°C. Commandés par un logiciel qui contient les données géométriques de l’objet à fabriquer, les mouvements du plateau et de la buse construisent l’objet couche après couche. Des bobines de fils de PLA (acide polylactique) biodégradable, d’ABS (acrylonitrile butadiène styrène) ou de PET (polyéthylène téréphtalate basse et haute densité) sont maintenant disponibles très couramment chez les industriels des polymères et en 2009 l’expiration des brevets FDM popularise cette technique et lui donne un fort développement.
- Autres types de procédés dérivés du FDM :
- FTI (Film Transfer Imaging) utilise un photopolymère ; après dépôt on illumine avec des lampes infrarouges ou un laser UV pour durcir les couches de résine (SLA StéreoLithography Apparatus) ;
- MJM (Modelage à Jets Multiples) dispose de plusieurs buses et des arrivées de mélanges pour avoir des couches de polypropylène et d’acrylates ;
- SLS (Selective Laser Sintering) quitte le domaine des polymères pour la métallurgie. Des couches successives de poudres de métal (aluminium, acier, titane…) sont déposées et sont frittées par un laser IR de puissance (2). Avec les brevets sur le SLS qui ont expiré en 2014, nombre d’entreprises se sont lancées avec des ateliers entiers d’imprimantes à la fabrication de pièces complexes en petites séries pour l’automobile, l’aéronautique et le spatial.
- Autres types dérivés du SLS :
- le SLM (Selective Laser Melting) : on fait fondre à haute température le fil métallique et on dépose des couches de métal fondu.
- le WAAM (Wire Arc Additive Manufacturing) est un peu une déviation de la soudure à l’arc, puisque le fil est une électrode mise en fusion par arc électrique et le métal fondu est déposé couche après couche. Ce procédé s’est fortement développé depuis 2020.
- le MBJ (Metal Binder Jetting), une nouvelle variante, consiste à projeter des gouttes de liants sur un lit de poudre métallique pour l’agglomérer, puis à passer la pièce dans un four de frittage ; le liant est alors brûlé et la pièce consolidée. L’avantage est que l’impression se fait à température ordinaire, et que l’on peut en faire des centaines en même temps : c’est la voie conduisant aux grandes séries.
Les applications
Les applications sont nombreuses.
Beaucoup de petites pièces d’électroménager sont fabriquées en plastique (polyéthylène, rilsan, nylon). Une fois le logiciel d’impression configuré, les imprimantes alimentées par des bobines de résines fonctionnent toutes seules ; la main d’œuvre est réduite ainsi que les coûts de fabrication. Dans les années 2000, la baisse des prix sur les imprimantes grand public de 200 € à 600 € et la possibilité de mutualiser des scanners 3D et des logiciels d’impression gratuits ont multiplié les « fab lab » dans les établissements d’enseignement ou les maisons de la culture. Après quelques années d’emballement, la FA s’est plutôt développée dans l’industrie et le « hobby » est devenu un épiphénomène.
En métallurgie et en matériaux composites, de nombreuses industries l’utilisent soit en sous-traitant à des ateliers spécialisés en FA, soit en interne pour des pièces complexes comme les hélices creuses pour les bâtiments de Naval Group fabriquées par WAAM ; ceci permet de réduire les stocks et les délais d’approvisionnement. Autre exemple : Constellium, le leader français sur l’aluminium commercialise une poudre d’aluminium Aheadd® CP1 étudiée spécialement pour les pièces des bolides de F1.
Dans le sport (3), pour la chaussure tout terrain de rugby et de football « Shark ONE », la semelle, les renforts et la forme ont été imprimés en 3D en PA11 (polyamide 11 ou rilsan) et Pebax® (constitué de blocs de polyamide et de polyéther), des matières éco-responsables de la société Arkema.
En défense, l’armée américaine a développé des mini-usines qui se déplacent sur le terrain avec des imprimantes 3D pour la fabrication de pièces cassées ou manquantes dans l’armement des armées sur le front. En Ukraine, des drones civils ont été modifiés pour porter des charges et de l’armement.
On se rappelle qu’au milieu des années 2000 un logiciel et les données 3D ont été mis sur le Net par un étudiant américain permettant de fabriquer un révolver presque en totalité en plastique et tirant de vraies balles. En 2025, les spécialistes de la lutte anti-terroriste nous mettent en garde sur la facilité et la disponibilité de telles fabrications sur la toile ou sur les réseaux sociaux à des fins criminelles.
Dans le domaine médical, l’extrapolation du prototypage rapide utilisé depuis plus de 30 ans a été un réel progrès pour l’odontologie et la chirurgie. À l’aide des images de l’IRM, on peut fabriquer des prothèses sur mesure et précises, même complexes (mâchoires, articulations de hanches, genoux…) assez rapidement et parfois en temps réel.
On est près de la science-fiction quand on parle d’impression d’organes humains.
Une société lyonnaise s’appuyant sur des découvertes du CNRS imprime de la peau (4). On prépare d’abord la bio-encre avec des cellules de peau, de la gélatine, un peu d’alginate et de fibrinogène. On passe ensuite à l’impression sur un support en atmosphère stérile puis dans un incubateur durant 21 jours. On imprime ensuite le derme par-dessus avec la même encre. Cette peau imprimée peut servir aux essais des firmes biopharmaceutiques pour les crèmes et cosmétiques, évitant les tests sur animaux.
La construction n’est pas en reste. La fabrication additive permet de construire des bâtiments. Un très beau projet réalisé en 2024 sur les composites résine–bois regroupant deux industriels de la charpente et de la FA, en collaboration avec l’École du Bois d’Épinal et l’École d’Architecture de Nancy ,vise à réaliser la première machine de « stratoconception » de 20 à 30 mètres pour des halls ou salles de sports.
Quels défis pour la FA ?
L’impression plastique continue à se développer mais elle doit tenir compte du recyclage des fils polymères dans une démarche d’économie circulaire menée par les chimistes. Les procédés de la FA sont ceux qui ont le moins d’impacts sur l’environnement, moins de matière, pas de déchets. Mais lors de la conception des logiciels d’impression, les algorithmes de l’intelligence artificielle peuvent optimiser les structures des pièces à fabriquer, en vue de performances spécifiques. Cette nouvelle application de l’IA commence à diffuser.
Le dernier défi à relever concerne la formation et le recrutement car on demande de plus en plus de compétences (5) dans ce domaine où chimie, polymères et matériaux sont les mots-clés pour cette industrie 4.0. Des salons sont consacrés à l’impression 3D où des acteurs du secteur présentent leurs réalisations et recrutent, comme le salon 3D Print à Lyon, par exemple.
Jean-Claude Bernier et l’équipe Question du mois
Pour en savoir plus
(1) La 3D, troisième révolution industrielle ?, J.-Cl. Bernier L'Actualité Chimique (juillet 2015)
(2) Le Laser en contexte industriel : une palette d’applications étonnantes, T. Engel, Colloque Chimie et lumière, Fondation de la Maison de la Chimie (février 2020)
(3) Le rôle des matériaux composites dans les performances sportives, Y. Rémond, Colloque Chimie et Sports en cette Année Olympique et Paralympique, Fondation de la Maison de la Chimie (février 2024)
(4) L’impression fait peau neuve, J. Leyes et B.Robert, Grand Prix Jeunes Journalistes de la Chimie 2018 (vidéo et article)
(5) Voir l’Espace Métiers de Mediachimie
Crédit illustration : capture vidéo L’impression fait peau neuve, J. Leyes et B.Robert, Grand Prix Jeunes Journalistes de la Chimie 2018
Tout d’abord qu’est-ce que le tartre ? Tartre et calcaire sont synonymes et tous les deux constitués de carbonate de calcium de formule chimique CaCO3, c’est-à-dire formés à partir des ions calcium Ca2+ et des ions carbonates CO32-.
Le carbonate de calcium est très présent dans la nature, dans les terrains dit calcaires : Bassin parisien, Nord, Alpes, Jura, Champagne crayeuse..., comme le montre la figure 1.
L’eau qui pénètre dans ces sols dissout une partie des sels présents et s’enrichit ainsi en sels minéraux avant d’atteindre les nappes phréatiques d’où elle sera pompée puis traitée et rendue potable.
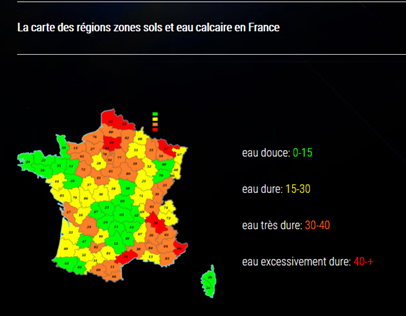
Figure 1 (i)
On définit la « dureté » de l'eau, paramètre qui mesure la quantité d’ions calcium et magnésium, présents dans l'eau. Elle s’exprime en degré TH (°f), pour Titre Hydrotimétrique français.
1 degré TH(°f ) = 4 mg de Ca2+ ou 2,4 mg de Mg2+ par litre d’eau.
On attribue les adjectifs « douce » ou « dure » aux eaux selon la valeur de ce TH.
Échelle (ii)
Notons que dans un terrain calcaire, l’eau s’est enrichie simultanément en ions calcium et carbonate.
Influence du pH sur les ions carbonates
Les ions carbonates participent à des équilibres acido-basiques, comme le montre la figure 2.
Le dioxyde de carbone CO2 est un acide faible et se transforme pour pH supérieur à 6,35 en ion hydrogénocarbonate (aussi appelé ion bicarbonate). Celui-ci se transforme en ion carbonate pour pH supérieur à 10,3.
L’eau du robinet a un pH compris entre 7,2 et 7,6. Il en est de même des eaux en bouteille non gazeuses. A ce pH, l’eau dure contient donc des ions calcium et des ions majoritairement sous forme d'hydrogénocarbonate et non de carbonate (cf. figure 2).

L’équilibre des espèces carbonatées dans l’eau
En réalité les trois espèces coexistent et sont toujours en équilibre dans l’eau, selon :
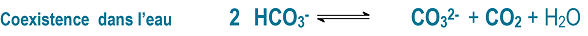
Dire que le bicarbonate est majoritaire c’est dire que les ions CO32- et le dioxyde de carbone CO2 sont très minoritaires mais présents.
Au final l’eau dure contient donc des ions calcium et des ions hydrogénocarbonates, qui restent dissous.
Que se passe-t-il quand on chauffe l’eau ?
Le chauffage de l’eau va favoriser le dégazage de CO2 dont la solubilité dans l’eau diminue si la température augmente. Cela va provoquer naturellement un déplacement de l’équilibre précédent vers la droite pour reformer du CO2. Mais il se forme donc simultanément des ions carbonate. Or les ions carbonates et les ions calcium ont une affinité l’un pour l’autre et vont précipiter sous forme de carbonate de calcium. La réaction qui a lieu est la suivante :
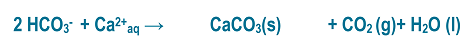
Le tartre s’est formé !
C’est la raison pour laquelle vous observez un dépôt de calcaire tout particulièrement sur les résistances de chauffe-eau, de lave-linge, de lave-vaisselle, dans les cafetières, dans les fers à repasser… Cela engendre des dépenses d’énergie supplémentaires, limite l’efficacité des savons et détergents, le linge est rêche…
Comment peut-on éviter ou éliminer ces dépôts ?
Comme nous l’avons vu (figure 2), les ions carbonates sont des bases donc l’action d’un acide va détruire le calcaire. C’est le rôle des détartrants ou du vinaigre que vous pouvez utiliser. La réaction qui a lieu est
CaCO3 + 2 H+ → Ca2+ + CO2 (gaz) + H2O
Evidemment on ne peut pas mettre un détartrant directement au cours d’un cycle de lave-linge ou de lave-vaisselle. Dans ce cas on peut adoucir l’eau en remplaçant les ions calcium par les ions sodium, c’est le rôle du « sel régénérant », constitué de chlorure de sodium pur (NaCl). On peut aussi ajouter à la lessive un composé qui réagit sur les ions calcium (on parle de séquestration ou de complexation) les empêchant de précipiter avec les ions carbonates(iii).
Pour limiter l’entartrage des résistances de chauffe-eau, on peut adoucir l’eau en amont de l’installation.
Consommation d’une eau dure
Boire une eau dure ne pose aucun problème de santé. Bien au contraire : n’oublions pas que l’ion calcium a une grande importance physiologique (os, dents) et qu’il participe au fonctionnement de la cellule et à la contraction musculaire. L’ion magnésium participe à de très nombreux processus biologiques, au bon fonctionnement du système nerveux et son apport est exclusivement nutritionnel.
On prendra soin de ne pas boire l’eau adoucie riche en ions sodium, car une consommation en excès de ces ions peut entraîner de l'hypertension artérielle.
Françoise Brénon
(i) Source https://la-meilleure-centrale-vapeur.fr/le-calcaire/
(ii) Source https://fr.wikipedia.org/wiki/Duret%C3%A9_de_l%27eau
(iii) ce sont souvent des tensioactifs anioniques de type carboxylate : RCOO- à longues chaine carbonée (R). Cela peut aussi être des hexamétaphosphates de sodium (Na6P6O18).
Crédit illustration : Résistance chauffe-eau, F. Brénon.
Au cours des années 2021 et 2022 des épisodes de grêle ont dévasté de nombreuses régions françaises et ont causé des dégâts considérables conduisant beaucoup de villages à des déclarations de catastrophes naturelles.
Comment se forme la grêle ?
La grêle se forme essentiellement dans de gros nuages humides appelés cumulonimbus dont l’épaisseur peut dépasser 10 km. Lors d’un orage l’été, la température du sol est souvent supérieure à 30 °C et des vents violents surviennent pouvant atteindre des vitesses de 150 km/h. Les gouttelettes d’eau sont entrainées rapidement par des courants ascendants et se refroidissent. En effet la pression atmosphérique baissant avec l’altitude, la température de l’atmosphère diminue quand l’altitude augmente : on parle dans ce cas de « détente adiabatique ». Les gouttelettes se refroidissent rapidement à des températures inférieures à 0 °C mais n’ont pas le temps de geler ; on dit qu’elles sont en « surfusion ». Ce n’est que dans la partie supérieure du nuage que la congélation a lieu sous forme de « noyau de glace » appelés grêlons. La zone orageuse est habituellement très localisée allant de 100 m3 au début de la formation de la grêle mais peut atteindre jusqu’à parfois 1 km3 !
Comment grossissent les grêlons ?
Les gouttelettes d’eau au contact des grêlons s’agglomèrent et grossissent. Les grêlons continuent à monter dans le nuage. Lorsque le courant ascendant ne compense plus le poids du grêlon, ce dernier commence à redescendre avec une vitesse limite constante tout en continuant de grossir. La structure des grêlons est donc constituée de couches successives de glace ce qui leur donne un aspect translucide. Lors de cette chute le grêlon peut sortir du nuage et peut alors commencer à se sublimer (il passe directement de l’état solide à l’état gazeux). Ceci explique que le grêlon dans l’atmosphère est plus gros que celui qui arrive au sol.
Le diamètre des grêlons dépend de leur vitesse de chute et peut varier de 1 cm (v = 35 km/h) à 20 cm (v = 120 km/h). La masse des grêlons peut prendre des valeurs très élevées parfois jusqu’à 1 kg !
Comment peut-on lutter contre les averses de grêle ?
Pour diminuer les risques de grêle on a pensé d’abord à ensemencer des nuages par des substances hygroscopiques. En effet l’augmentation du nombre des noyaux de congélation diminue alors la taille des grêlons. Ainsi a-t-on un moment utilisé des cristaux d’iodure d’argent (AgI) à raison de 10 µg/m3 mais cela s’est révélé potentiellement toxique à l’échelle du nanogramme sur les voies respiratoires de l’organisme. L’emploi du chlorure de calcium (CaCl2) a donné des résultats peu reproductifs, tout comme l’usage des canons anti-grêle par désagrégation des grêlons à l’aide d’ondes de choc ! La protection des vergers par l’emploi de filets contre la grêle reste encore le moyen le plus répandu et le plus efficace.
Étant constitué de glace, un grêlon présente une réflectivité (énergie réfléchie) très faible aux ondes radar utilisés en aéronautique, ce qui rend difficile la distinction entre des petits grêlons et des gouttes d’eau. Cependant un signal radar très fort peut révéler la présence de gros grêlons qui peuvent être responsables de la détérioration des turboréacteurs ou des matériaux d’isolation utilisés dans les travaux de couverture et d’isolation des bâtiments. Seuls des relevés par des observateurs et des passionnés de météorologie fournissent des informations sur la localisation de ces phénomènes. La Mission des Risques Naturels de l’ANELFA et le Bureau d’Etudes Kéraunos récoltent des données des sinistres occasionnés par la grêle qui permettent d’établir ainsi des cartes de la fréquence de ces événements météorologiques par commune et par saison.
Note : La formation de la grêle est très différente de celle de la neige ! Cette dernière a lieu dans des nuages à faibles mouvements, à des températures au sol inférieures à 0 °C, donnant des petits cristaux de glace qu’on appelle flocons.
Jean-Pierre Foulon
Voir aussi Contre la sécheresse faut-il ensemencer les nuages ?, éditorial de mai 2023 de J.-Cl. Bernier (Mediachimie.org)
Crédit illustration : soupstock / Adobe Stock
Le charbon actif (CA) est utilisé pour traiter des problèmes de pollution de plus en plus prégnants. Il n’est à confondre ni avec le biochar (i) ni avec le noir de carbone (ii).
Comment est-il préparé ?
Le CA est d’abord obtenu par pyrolyse (carbonisation) actuellement à partir de végétaux tels que du bois, des tiges de bambou, des coquilles de noix, ou de coco principalement à une température de l’ordre de 500 °C. Il faut par exemple 50.000 noix pour faire 1 tonne de charbon actif ! Il y a expulsion du gaz carbonique, d’acides organiques volatils contenus dans la matière initiale. On obtient du carbone presque pur de structure caverneuse présentant une surface poreuse d’environ de 5 m2/g. À la différence du noir de carbone, le traitement se poursuit par une activation. Il s’agit dans un premier temps d’un chauffage en présence de vapeur d’eau vers 800 °C. Sous l’action de la température élevée et de la vapeur, la matrice carbonée est littéralement criblée ce qui augmente sa porosité. Dans un second temps un chauffage vers 500 °C en présence d’agents chimiques tels que l’acide phosphorique augmente le nombre des pores permettant d’atteindre des micropores de 1 nanomètre (nm) et une surface de l’ordre de 1500 m2/g dans le charbon actif issu de coques et seulement de 2 à 50 nm pour celui issu des bois. Le CA produit est hygroscopique mais peut adsorber les produis organiques, par exemple 0,5 kg de toluène par kg de carbone. Selon les conditions expérimentales on distingue deux grandes variétés de CA.
Le charbon actif en poudre (CAP) possède une très fine granulométrie de l’ordre de 20 µm environ et de masse volumique d’environ 400 kg/m3. Il est utilisé dans le traitement des eaux pour des pollutions accidentelles à raison de 20 mg/L pour éliminer en particulier des polluants organiques à une concentration pouvant atteindre une concentration de 1.500 mg/m3 et qui sont responsables essentiellement des mauvais goûts et des odeurs désagréables des eaux.
Le charbon actif en grains (CAG) est constitué d’une granulométrie plus de l’ordre du millimètre. Il est trois fois plus cher que le CAP et est utilisé pour éliminer les polluants organiques tels que les pesticides, les composés biologiques non biodégradables et les PFAS. C’est une des étapes dans les unités de traitement des eaux pour l’obtention d’eau potable.
Le plomb et les métaux lourds ne sont pas éliminés de cette façon. L’adoucissement de l’eau n’est pas réalisé par le charbon actif. Par contre si l’eau a été adoucie via le remplacement des ions calcium par des ions sodium (sel pour adoucisseur), le passage de cette eau sur du charbon actif ne modifie pas l’adoucissement.
La régénération du charbon actif nécessite de casser les liaisons existant à la surface du CA. Actuellement le CAP chargé des impuretés est récupéré sous forme de boues et incinéré. Pour le CAG, le « décrassage » peut nécessiter un chauffage vers 1000 °C pour volatiliser les impuretés adsorbées ou dans certains cas un simple lavage avec des solutions aqueuses d’acides ou de bases par exemple.
Les applications du CA sont nombreuses. Outre le traitement de l’eau, il peut être utilisé pour décolorer les jus sucrés, par exemple le sirop de glucose. Les cartouches filtrantes des masques à gaz contiennent du CA pour fixer les gaz toxiques comme les COV (composés organiques volatils) et les dioxines contenues dans les fumées d’incinération. Le CA est aussi présent dans des éco-textiles pour éliminer les odeurs corporelles, dans des hottes aspirantes, dans les filtres à cigarettes…
En médecine, sous forme de granulés, il est employé pour traiter un grand nombre d’intoxication digestive, diarrhée, gastroentérite. Il ne présente pas d’effet toxique mais ne doit pas être conseillé par exemple lors de prise de traitements anticonceptionnels car le CA fixe le principe actif.
Les utilisations du CA se répartissent selon (iii) :
- Traitement de l’eau 40 %,
- Purification de l’air 22 %,
- Agroalimentaire 18 %,
- Pharmacie, médecine 6 %,
- Automobiles 4 %.
La production mondiale dépasse actuellement les 2 millions de tonnes.
Jean-Pierre Foulon
(i) Voir la Question du mois « Qu’entend-on par biochar ? » J.-P. Foulon, Mediachimie.org
(ii) Voir le Zoom sur le noir de carbone, J.-P. Foulon, Mediachimie.org
(iii) Source : Charbon actif sur le site l’Elementarium
Crédit illustration : Charbon actif sous forme de poudre et de bloc, Ravedave / Wikimedia Commons, licence CC BY-SA 3.0
Bientôt les fêtes, et donc la période des gâteaux ! Pour faire des gâteaux, on utilise des matières grasses, de l'eau, éventuellement des œufs, mais les deux ingrédients essentiels sont le sucre(i) et la farine.
Ici on ne va s’intéresser qu’à la farine ou plutôt aux différentes sortes de farine. En effet il n'y a pas que la farine de blé, car de nombreuses plantes, et pas seulement des céréales, peuvent donner des farines utilisables en cuisine. Elles sont obtenues en broyant des graines de céréales (blé, orge, épeautre, maïs...), de légumineuses (lentilles, pois chiches, haricots, soja…), de racines (manioc, pommes de terre), etc.
Elles contiennent toutes essentiellement de l’amidon. Il y a également des protéines (gluten par exemple), et d’autres composés comme des fibres si la farine est faite avec des graines complètes (avec leurs enveloppes).
L’amidon n’est pas constitué d’une seule et même molécule mais a une structure complexe qui varie selon la plante dont il est issu, d’où l’apparition de différences entre les farines.
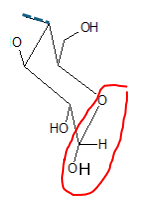
Pour comprendre cela, il nous faut tout d’abord parler du D-glucose et de ses polymères à partir desquels est constitué l’amidon. On peut le représenter dans un plan et en perspective. Mais le cycle n'est pas plat, et on préfèrera la représentation dite « chaise ». Il existe 2 structures(ii) nommées α et β, selon la position dans l’espace du groupe OH porté par le carbone numéroté 1 (figures 1a et 1b). Le D-glucose est un sucre simple.
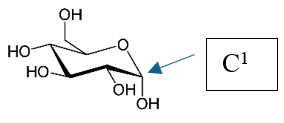 | 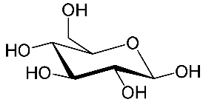 |
| Fig. 1a. α-D glucose | Fig. 1b. β-D glucose |
Les polymères de glucose et l'amidon
Des molécules de D-glucose peuvent s’associer entre elles pour donner de longues chaines appelées polymères de glucose. Il y a dans la nature de nombreux homopolymères(iii) du glucose selon la façon dont les molécules s’enchaînent.
On observe ainsi parmi ceux-ci(iv), deux enchainements possibles conduisant à deux homopolymères de glucose, l’amylose et l’amylopectine, qui constituent l’amidon.
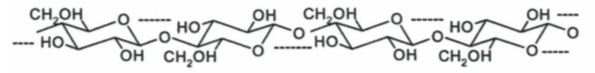
- L’amylose est un polymère linéaire formé de plus de 1.000 unités D-glucose liés par des liaisons O-glycosidiques (α-1,4) (figure 2a).
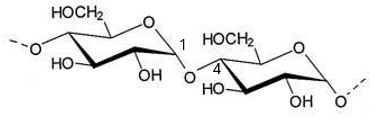
Fig. 2a. Les numéros des atomes de carbone auxquels est lié l’atome O sont indiqués.
Elle prend une structure hélicoïdale stabilisée par des liaisons hydrogène entre les unités (6 unités par tour d’hélice) (figure 2b).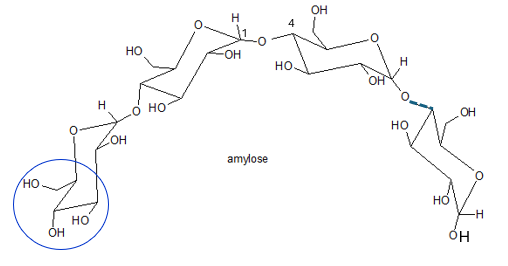
Fig. 2b. Amylose : Structure partielle ; le pointillé indique que la chaine se prolonge. - L’amylopectine est ramifiée et comporte plus de 10.000 unités D-glucose unies par des liaisons O-glycosidiques intra-chaînes (α-1,4) et inter-chaînes (α-1,6) (figures 3a et 3b).
Il y a un branchement toutes les 20 unités environ. Sa structure est plus désordonnée que celle de l'amylose.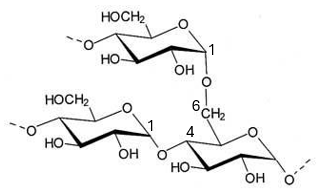
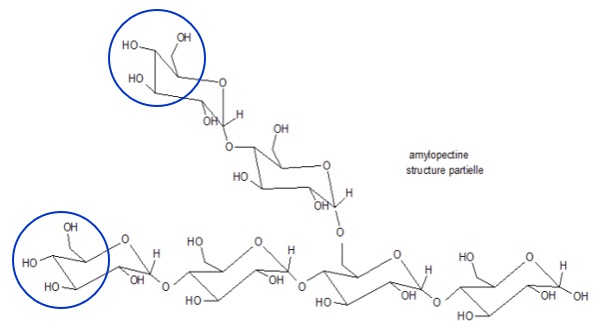
Fig. 3a. Les numéros des atomes de carbone sont indiqués Fig. 3b. Structure partielle simplifiée ; 1 seule ramification est représentée et les chaines sont évidemment plus longues.
Les farines et les compositions de leur amidon
Les proportions entre amylose et amylopectine vont être caractéristiques de l’amidon de chaque farine, dont la teneur en protéine (gluten ou autre…) est également spécifique. Ainsi blé, épeautre, orge, seigle contiennent du gluten tandis que millet, sorgho, avoine, quinoa, sarrasin n'en contiennent pas.
Pour ce qui est des ratios amylose/amylopectine on observe :
blé 35/65, maïs 25/75 (mais selon les cultivars(v) on peut avoir des chiffres très différents, comme des maïs avec un ratio jusqu'à 70/30 !), pour le manioc, la pomme de terre, en revanche il y a peu d'amylose, 20/80, et pour le riz il y a de fortes variations d’un riz à l’autre la teneur en amylose pouvant aller d’une valeur inférieure à 5% jusqu’à une valeur supérieure à 24%.
Les fécules : ce ne sont pas des farines
La plus connue est la Maïzena®. Attention ! Il s'agit d'une marque déposée et appartenant à Unilever(vi) Il vaut mieux parler de fécule de maïs. Pour faire de la fécule, on met la farine en suspension dans l'eau, on agite énergiquement et on rince plusieurs fois : on a ainsi enlevé les protéines (gluten par exemple) qui partent dans l'eau.
La fécule ne contient donc que de l'amidon, ce qui donne une poudre plus fine. Nous voilà donc de retour vers l'amidon ! Il est donc logique que les diverses fécules se distinguent par leur proportion en amylose et amylopectine, comme les farines dont elles sont issues.
La fécule est un excellent liant pour les sauces et facilite leur préparation. Il est plus facile de faire une sauce avec une fécule (celle de maïs) qu'avec de la farine.
Elle est aussi un excellent gélifiant ou épaississant. Les amidons, mis en suspension dans l'eau, chauffés puis refroidis, donnent des gels d'autant plus fermes que l'amidon est riche en amylose. En effet, les chaînes linéaires d'amylose se réassocient au cours du refroidissement, ce que ne peuvent faire les chaînes ramifiées d'amylopectine. Ainsi ceux riches en amylose (maïs) sont utilisés dans les poudres pour faire des flans. Les amidons riches en amylopectine (pomme de terre) sont plus des épaississants que des gélifiants.
La fécule est plus fine que la farine de blé et sert à alléger la pâte des gâteaux. Deux cuillerées de farine de blé équivalent à une de fécule de maïs quant à l'effet épaississant. Comment cela s'explique-t-il ? la farine est faite à partir de la mouture de la totalité de la graine (amidon + germe + enveloppe du grain), alors que la fécule ne contient que de l'amidon.
Quels critères pour choisir parmi les farines ?
Les enzymes, amylases, catalysent la digestion de l'amidon qui consiste globalement en une hydrolyse lente conduisant in fine au glucose. L’enzyme facilite la coupure des liaisons O-glycosidiques qui relient les cycles en partant d’une extrémité non réductrice de la molécule puis de proche en proche. En raison de sa structure, l'amylose est digérée plus lentement que l'amylopectine(vii). Cela peut être un critère de choix.
Actuellement, la « mode » en diététique, est de s’intéresser à l'index glycémique, IG(viii). L'IG permet de classer les aliments en fonction du pic de sucre qu'ils provoquent dans le sang. Un IG élevé, supérieur à 70, provoque un pic de la glycémie puis une chute rapide qui peut entraîner un effet « coup de barre ». Un aliment à IG modéré, entre 40 et 69, ou bas, inférieur à 40, diffuse de l'énergie plus progressivement dans l'organisme. C'est pour cet effet que certaines farines sont recommandées (voir en note le tableau d’Indice Glycémique de diverses farines(ix)).
Mais il ne faut pas se fier exagérément à l'IG, car les farines contiennent aussi des protéines, et des matières grasses, quel que soit leur IG. Il faut plutôt privilégier les farines complètes pour leurs meilleures qualités nutritionnelles. Concernant l’intolérance au gluten, les personnes concernées rechercheront pour leur régime des farines pauvres en gluten (riz, maïs, sarrasin, châtaigne, épeautre).
Conclusion
Que choisir, farine ou fécule ? La farine reste incontournable comme « matériau de base ». La fécule est un « outil » qui permet d'épaissir une sauce et de remplacer une partie de farine en rendant le plat obtenu moins énergétique puisque moins riche en glucose (50 g de fécule remplace 100 g de farine).
Coté diététique, les gâteaux restent très énergétiques car ils contiennent des matières grasses, du sucre et de la farine ou de la fécule, qui n’oublions pas conduiront à du glucose au cours de la digestion. Donc faites-vous plaisir mais avec modération si vous voulez « garder la ligne » !!
Nicole Moreau et Françoise Brénon
(i) Le sucre de table habituel est du saccharose de formule C12H22O11. Son hydrolyse conduit à du glucose et du fructose. C’est ce qui se passe au cours de la digestion du sucre.
(ii) Ces 2 structures sont dites anomères et le carbone n°1 est un site anomérique. Elles sont en équilibre par ouverture puis fermeture du cycle au niveau de la fonction acétal (entourée en rouge sur la figure ci-contre).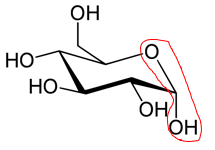
(iii) « homo » signifie qu'il s'agit du même sucre répété plusieurs fois, le contraire étant « hétéro ».
(iv) Il existe un autre enchainement de D-glucose (β-1,4) qui conduit à la cellulose polymère de structure des végétaux, qui peut former des fibres.
(v) Le cultivar est une variété de plante obtenue par sélection.
(vi) Maïzena sur Wikipedia.
(vii) En effet, l’attaque commence par les extrémités non réductrices des molécules de l’amylose et de l’amylopectine. Voir sur les figures 2b et 3b les parties entourées en bleu. Pour une chaîne d'amylose, il n'y a qu'une extrémité non réductrice, alors qu'il y en a plusieurs (en raison des ramifications) pour une chaîne d'amylopectine. L’extrémité réductrice est la fonction acétal (entouré en rouge) capable de s’ouvrir pour redonner l’aldéhyde réducteur. En outre, l'amylose adopte une conformation hélicoïdale, rendant l'accès des enzymes plus difficile.
(viii) Pour en savoir plus sur l’Index Glycémique, consulter Indice Glycémique sur le site Wikipedia et L’index glycémique, c’est quoi ? sur le site France Assos Santé
(ix) Indice glycémique de diverses farines
| Farine | IG |
| Son d'avoine, son de lupin | 15 |
| Amande, noisette, cacahuète | 20 |
| Soja | 25 |
| Orge mondée | 30 |
| Lentille, coco, pois chiche | 35 |
| Sarrasin, petit épeautre, avoine, | 40 |
| Quinoa, épeautre complet, blé T150 | 45 |
| Seigle T130 | 50 |
| Blé T80 | 60 |
| Châtaigne | 65 |
| Maïs, millet | 70 |
| Riz complet | 75 |
| Blé T45, fécule de maïs | 85 |
| Riz blanc, fécule de pomme de terre | 95 |
La lettre T indiquée pour certaines farines indique le taux de cendre. Plus le T est élevé, plus la farine sera complète, plus le T est bas plus la farine de froment sera blanche et riche en amidon.
Pour aller plus loin
Des additifs pour texturer des aliments, M. Desprairies, La chimie et l’alimentation, coordonné par Minh-Thu Dinh-Audouin, Rose Agnès Jacquesy, Danièle Olivier et Paul Rigny (EDP Sciences, 2010) ISBN : 978-2-7598-0562-4, p. 83
Crédits
- Figures 1a et 1b : α-D glucose et β-D glucose, Wikipedia, domaine public
- Figures 2a et 3a : Sauget, Alix, Développement de matériaux composites fibreux hautes perfomances à matrice bio-sourcée. (Thèse, Université de Lorraine, 2014) figures complétées
- Figures 2b et 3b : Zubay, Geoffrey, Biochemistry (Addison-Wesley, 1983) ISBN 0-201-09091-0
- Illustration : F. Brénon, travail personnel
Dans le monde de l’art, une peinture dont les couleurs se dégradent perd son attrait et sa valeur. Les conservateurs des musées, les collectionneurs et les peintres redoutent ces phénomènes de dégradation. Conserver les couleurs originelles d’une œuvre d’art présente un enjeu esthétique et économique auquel les chimistes, les physiciens et les biologistes s’intéressent depuis très longtemps.
Couleurs des pigments
Un pigment est « un matériau insoluble dans le milieu dans lequel on le disperse, par opposition au colorant, soluble dans le milieu dans lequel il est dispersé » (1).
Les pigments organiques naturels (d’origine végétale ou animale) et synthétiques (fabriqués en laboratoire) contiennent essentiellement des atomes de carbone et d’hydrogène. Ils sont constitués majoritairement d’une alternance de liaisons simples C-C et de liaisons doubles C=C entre des atomes de carbone. Ces liaisons dites conjuguées (alternées) sont des chromophores, responsables de la couleur des pigments organiques (alizarine, indigo, mauvéine...). Les molécules absorbent dans le domaine du visible (à des longueurs d’onde λ comprises entre 400 et 800 nm) et réfléchissent la ou les radiations non absorbées (dites complémentaires). La présence de groupes auxochromes (du grec auxein : accroitre) modifie les longueurs d’onde des radiations absorbées (2).
Les pigments inorganiques (ou minéraux) ont des couleurs liées à la composition chimique d’édifices contenant des ions métalliques (fer, chrome, cobalt, nickel, manganèse, cuivre…) entourés par des molécules ou des ions (eau, sulfure, oxyde, hydroxyde…). Ces composés absorbent également dans le domaine visible et réfléchissent les radiations non absorbées. Les longueurs d’onde de ces radiations dépendent de la nature du métal et des molécules ou des ions qui l’entourent. L’oxyde de fer (III) Fe2O3 (hématite) est rouge tandis que l’hydroxyde oxyde de fer (III) (Goethite) FeO(OH) est jaune (3).
Il arrive parfois que les impuretés du pigment soient responsables de sa couleur : le pigment alumine Al2O3 est blanc ; et en présence de traces d’ions Cr (III) piégés (0,0000000001 %), il a une couleur rouge (rubis) (4).
Dégradation des couleurs des pigments
Lorsque les molécules responsables de la couleur des pigments organiques sont irradiées par des lumières naturelle ou artificielles, elles absorbent une partie de l’énergie lumineuse et se retrouvent dans un état dit « excité », plus haut en énergie que l’état dans lequel ils se trouvaient au départ. Si cette transition énergétique, appelée absorption, se fait dans le domaine ultraviolet (λ < 380 nm) la molécule se retrouve dans un état excité (état instable) et peut subir des transformations structurales. Lorsqu’elle revient dans son état le plus stable (état fondamental) elle ne retrouve pas toujours l’alternance des liaisons simples et doubles, par conséquent elle n’absorbe plus dans le domaine visible et ne participe plus à la couleur du pigment. Progressivement, au fil des jours et des années, le nombre de molécules responsables de la couleur diminue et le pigment parait de plus en plus terne (5).
La dégradation de la couleur peut aussi provenir d’une oxydation du pigment. Vincent Van Gogh, dans une lettre adressée à sa sœur le 6 juin 1890, décrit la couleur des deux chemins « de sable ensoleillé rose » qui contournent l’église du tableau L’église d’Auvers-sur-Oise, vue du chevet (1890). La laque utilisée contenait de l’éosine. La couleur rose a été modifiée par un phénomène d’oxydation photochimique : dans un état excité la molécule d’éosine devient plus sensible à l’oxydation (son pouvoir réducteur augmente) et se transforme en une autre molécule. Au fil du temps, les deux chemins sont passés du rose au marron.
Les pigments inorganiques sont réputés pour leur stabilité. Néanmoins, certains peuvent s’oxyder et changer d’aspect. Dans les œuvres Le Cri (1893), d'Edvard Munch, et La Joie de vivre (1905-1906), d'Henri Matisse, le sulfure de cadmium CdS s’est oxydé à l’air pour se transformer en sulfate de cadmium CdSO4 : certaines parties de ces tableaux sont passées du jaune vif au blanc cassé (6).
Dégradation de la couleur du mélange « pigment + liant »
Le bleu outremer est un pigment qui a fait l’objet de nombreuses études scientifiques. Le pigment naturel était extrait dès le Moyen Âge du lapis-lazuli. Il est très onéreux ; et est utilisé par Johannes Vermeer en 1658 pour peindre le tablier bleu de La Laitière. En 1826, Jean Baptiste Guimet met au point la synthèse du bleu outremer et remporte le prix initié par la Société d’encouragement pour l’industrie nationale.
La couleur du bleu outremer est due à la présence d’atomes de soufre (emprisonnés dans des cages d’aluminosilicates) (3) qui absorbent une partie de la lumière visible et réfléchissent des radiations lumineuses bleues. En 1827, Jean Auguste Dominique Ingres utilise ce pigment synthétique pour le bleu de la toge d’Apelle dans l’Apothéose d’Homère. En 1908, Vassily Kandinsky peint la surface de l’eau dans Paysage d’automne avec bateaux.
Au fil des années, on a observé que les parties peintes au bleu outremer ont blanchi dans de nombreuses œuvres majeures. Des études de vieillissement contrôlé ont montré que le blanchiment n’est pas dû à l’humidité ni à chaleur ; mais qu’un environnement acide ainsi que les radiations lumineuses en sont responsables. Dans les conditions muséales, l’atmosphère n’est pas acide ; donc seule la lumière peut provoquer le blanchiment des peintures au bleu outremer.
Les chercheurs ont tout d’abord éclairé le pigment seul. Sa couleur reste bleue. Puis ils ont éclairé le mélange « pigment + liant » : il blanchit après plus de 1000 heures d’exposition. Sous l’effet de la lumière, les cages d’aluminosilicates qui entourent les atomes de soufre accélèrent la dégradation du liant : il y a un effet photocatalytique. Le liant se retrouve dans un état fragmenté et rugueux : les petits grains se comportent comme des miroirs et réfléchissent davantage la lumière, provoquant ainsi un effet de blanchiment (7).
Protection des pigments avec des filtres anti UV
Les radiations lumineuses sont à l’origine de nombreuses dégradations des couleurs des pigments. Les peintres protègent leurs œuvres avec des vernis contenant des filtres anti-UV. Ce sont actuellement des molécules organiques (octocrylène, avobenzone…) qui absorbent les rayonnements UV et convertissent une partie de l’énergie lumineuse en énergie thermique.
Dégradation de la couleur du vernis
Un vernis est un liquide contenant une résine dispersée ou solubilisée dans une essence. Il a une fonction esthétique (mat ou brillant) et protectrice. Les résines naturelles (copal, mastic, Dammar…) et synthétiques (acrylique, polyuréthane…) sont constituées de polymères organiques.
Un vernis déposé sur un tableau se doit d’être incolore afin de ne pas modifier la teinte des peintures qu’il protège. Au fil des années, les vernis ont tendance à jaunir et les couleurs du tableau sont par conséquent dégradées (8).
En réalité, le jaunissement commence lorsque la résine naturelle est récoltée de l’arbre. Le dioxygène de l’air provoque la formation de radicaux (très réactifs) qui déclenchent des réactions en chaine de diverses natures. Elles conduisent à augmenter les tailles des polymères et à créer des ramifications, dont certaines contiennent des chromophores. L’exposition des vernis aux UV de la lumière accélère ce processus de jaunissement, qui a démarré avant même que le vernis ne soit déposé sur le tableau (9).
Enfin, il peut y avoir des réactions chimiques entre les molécules contenues dans le vernis et les ions métalliques (fer, manganèse, plomb …) qui constituent les pigments inorganiques. Des édifices appelés complexes peuvent se former et provoquer l’apparitions de couleurs supplémentaires (10).
La dégradation des couleurs des peintures est un sujet scientifique passionnant. Les méthodes d’analyses évoluent chaque année. Les chercheurs du Centre de recherche et de restauration des musées de France (C2RMF) s’intéressent en particulier aux effets du changement climatique sur les pigments, les liants et les vernis des œuvres d’art, ainsi que sur les composés chimiques utilisés pour une restauration et une conservation « respectueuses et durables » (11).
Freddy Minc
Pour en savoir plus
(1) Les pigments et les colorants : on en parle ?, M. Jaber et Ph. Walter, L’Actualité Chimique n°444-445 (octobre-novembre 2019) p. 13-15
(2) Dye structure and colour, O. N. Witt sur le site Britannica
(3) La chimie crée sa couleur… sur la palette du peintre, B. Valeur, article du colloque La Chimie et l’Art (2009) sur Mediachimie.org
(4) Diamant, saphir, émeraude… Gemme, la couleur de tes défauts, conférence de Emmanuel Fritsch et Benjamin Rondeau (2006)
(5) Eté : les UV abîment-ils les couleurs des objets ?, V. Handweiler sur le site de Sciences et Aveni
(6) Zoom sur les pigments, J.P. Foulon sur Mediachimie.org
(7) Quand la peinture bleu outremer perd des couleurs, A. Michelin sur le site du MNHM et Pourquoi certains tableaux vieillissent mieux que d'autres, A. Michelin sur le site The Conversation
(8) Identification non-destructive des vernis des œuvres d’art par fluorescence UV, M. Thoury, thèse, HAL Id tel-00164825 , version 1
(9) La dégradation des vernis (PDF), B. Achette, Musée Fabre dossier pédagogique mission Arts et Sciences au service éducatif
(10) Aging and yellowing of triterpenoid resin varnishes - Influence of aging conditions and resin composition, P. Dietemann et al., Journal of Cultural Heritage 10 (2009) pp. 30-40
(11) Centre de recherche et de restauration des musées de France (C2RMF)
Crédit illustration : Lapis luzuli - Adobe Stock © Björn Wylezich
Le méthane, CH4, est le principal constituant du mélange gazeux d'hydrocarbures, appelé gaz naturel, qui s’est formé par sédimentation et décomposition de matières organiques sur des millions d’années aussi bien dans des terrains sédimentaires qu’au fond des océans. Il fait ainsi parti des énergies fossiles et est très largement utilisé à des fins énergétiques (centrales thermiques, carburant...).
C’est aussi l'hydrocarbure le plus abondant dans l'air, car il est produit naturellement, en particulier dans les zones humides : gaz des marais, responsable de la formation des feux follets, qui terrifiaient nos ancêtres il n'y a pas si longtemps. C’est en étudiant ce gaz des marais que Alessandro Volta (celui qui a inventé la pile voltaïque) l’a découvert en 1776 (1).
Le méthane est produit par fermentation anaérobie (i), de la matière végétale grâce à divers micro-organismes.
En mimant la nature, il peut aussi être produit volontairement à partir de déchets organiques dans des installations spéciales de méthanisation, allant d’unités de petites tailles « à la ferme » jusqu’à des usines. On est donc ici dans un processus de renouvelabilité. C’est ainsi que le méthane issu de ces procédés est appelé « biogaz » ou « biométhane ».
Historique
Le principe de gestion des déchets apparaîtra en France au XVIe siècle, lorsque François Ier démocratise l'emploi des paniers pour récupérer les déchets ménagers. En 1883, le préfet de la Seine Eugène Poubelle (2) invente le célèbre récipient qui porte encore son nom. En 1922, à l'initiative de la ville de Paris, est créée la société TIRU (3), qui, après la loi « Grenelle 1 » (4), et la reprise par le groupe Paprec, devient une société qui conçoit, construit et exploite des unités de valorisation des déchets, en particulier par méthanisation.
Comment est gérée la méthanisation (5) ?
Selon l'arrêté du 23 novembre 2011 (modifié par l'arrêté du 24 juin 2014) (6) fixant la nature des intrants dans la production de biométhane pour l'injection dans les réseaux de gaz naturel, peuvent être méthanisés des déchets : agricoles (fumier, lisier, sous-produits animaux, résidus de cultures…), de l'industrie agroalimentaire (fruits et légumes, déchets d'abattoirs…), urbains (biodéchets ménagers triés, ou issus de la restauration collective, des grandes et moyennes surfaces, déchets verts, boues de stations d'épuration…), et industriels (eaux de lavage de procédés industriels, boues industrielles, graisses…).
Depuis le 1er janvier 2016, conformément à la loi Grenelle II (ii), les entreprises et les professionnels de la restauration doivent traiter leurs biodéchets s’ils en produisent plus de 10 tonnes/an et ainsi éviter la mise en décharge, aboutissant à un tassement, donc à un milieu anaérobie, producteur de gaz à effet de serre (dont surtout le méthane !). À l’horizon 2025, dans le cadre de la loi de transition énergétique, l’intégralité des biodéchets en restauration devra être triée à la source, y compris ceux des ménages (7).
Comment s'obtient ce biométhane ?
Les déchets fermentescibles sont stockés dans une cuve cylindrique et hermétique que l’on appelle « digesteur » ou « méthaniseur » dans laquelle ils sont soumis à l’action de micro-organismes (bactéries) en l’absence d’oxygène. Les réactions biologiques mises en jeu par la méthanisation sont complexes, mais globalement on repère trois grandes étapes : l’hydrolyse et l’acidogénèse où les chaînes organiques complexes (protéines, lipides, polysaccharides) sont transformées en composés plus simples (acides gras, peptides, acides aminés) suivi de l’acétogénèse où les produits de l’acidogénèse sont convertis en acide acétique et enfin la méthanogénèse où l’acide acétique est transformé en méthane et en gaz carbonique.
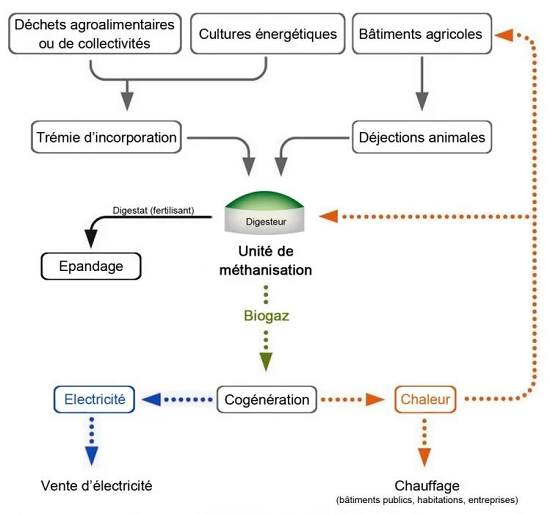
Schéma explicatif du processus de méthanisation (©Connaissance des Énergies)
Source https://www.connaissancedesenergies.org/fiche-pedagogique/methanisation
Le processus produit deux sortes de composés, le Biogaz et le Digestat. Le processus produit aussi des CSR, Combustibles Solides de Récupération, utilisables en cimenterie. Le biogaz, appelé Biométhane après purification et odorisation , est envoyé dans les réseaux et sert à produire de l'énergie pour les usages industriels, domestiques, ou comme carburant (il est alors appelé GNV (iv)(v)). Le digestat peut lui aussi être utilisé, sa partie liquide, riche en azote sous forme ammoniacale comme engrais, et la partie solide comme amendement des sols qu'il enrichit et restructure (compost).
Ce processus peut aussi être réalisé dans les exploitations agricoles où il permet d'éviter l'émission libre de méthane dont l'effet de serre, 25 fois plus puissant que celui du dioxyde de carbone, le rend dangereux pour l’environnement.
Bénéfices pour l'environnement
La valorisation énergétique des déchets joue un rôle important dans la mise en œuvre de la transition énergétique et écologique de notre pays à double titre : en tant que solution de traitements des déchets, complémentaire du recyclage ; dans une logique de souveraineté et d’élargissement du mix énergétique.
Déjà, l’incinération avec récupération d'énergie entraîne une économie significative de combustibles fossiles (gaz, fioul, charbon…). Elle permet, par la vente de l'énergie, de diminuer d'au moins 20 % le prix de traitement des déchets urbains. Elle réduit de 90% le volume et de 70% la masse des déchets. Mais elle entraîne un dégagement de CO2.
Mais l’intérêt de la méthanisation est de pouvoir faire une double valorisation :
- une valorisation matière via la production du digestat : 90% des matières entrantes seront transformées en engrais organique, local et renouvelable, qui permet de remplacer les engrais minéraux actuellement utilisés, dont la synthèse implique des énergies fossiles et l'importation de composés comme les phosphates, ou la potasse, coûteux.
- une valorisation énergétique via la production du biogaz : 10% des matières entrantes sont transformées en biogaz renouvelable, en remplacement de gaz fossile importé.
Les déchets organiques sont en effet une matière parfaitement recyclable, dont notre agriculture a besoin, et qui ne doivent plus être jetés en mélange avec les déchets ultimes : leur tri à la source, pour produire du compost ou du digestat utilisés pour fertiliser les champs, évite leur gaspillage et des importations et augmente le taux de valorisation des déchets non dangereux. Leur valorisation en méthanisation participe à la production d'énergie renouvelable.
Développement de la méthanisation
L'Europe est la principale zone de production de biogaz par méthanisation. Le processus se développe d’abord en Allemagne et en Italie, puis en France.
Selon le Commissariat général au développement durable, le nombre d'installations de sites d'injection de biométhane en France, de 1 en 2011, 17 en 2015, 214 en 2020, 551 en 2023 devrait continuer à fortement augmenter dans les prochaines années, au regard des nombreux projets en cours et au fort potentiel de la filière (7000 sites prévus en 2050).
Mais il faut rester vigilant quant à l'utilisation des « cultures énergétiques » (8). En effet, les possibles changements d’usage des terres et/ou des systèmes de production pour assurer l’alimentation du méthaniseur, production de cultures dédiées sur des terres anciennement dédiées à la production alimentaire (terres arables ou prairies) ; modification des successions de cultures pour maximiser l’insertion de cultures intermédiaires à vocation énergétique (CIVE) peuvent conduire à une possible compétition avec l'alimentation, d'où un impact sur les volumes et les prix, voire une annulation de l'intérêt climatique de la méthanisation.
Par exemple, en Allemagne la politique publique a favorisé un fort développement des surfaces en maïs pour l’alimentation des méthaniseurs, en partie au détriment des surfaces en prairies. L'Italie a tendance à suivre ce modèle, mais de façon plus modérée, grâce à des fermes diversifiées.
Nicole Moreau et l’équipe question du mois
(i) anérobie = sans oxygène. Le contraire est aérobie
(ii) directive mise à jour en décembre 2023 https://www.ecologie.gouv.fr/politiques-publiques/biodechets
(iii) Quel que soit le procédé, le traitement comprend au moins les 3 étapes : désulfurisation, qui enlève le SH2; déshydratation, qui enlève l'eau; décarbonation, qui enlève le CO2.
(iv)Tout gaz injecté dans le réseau de distribution doit posséder une odeur suffisamment caractéristique pour qu'une fuite puisse être immédiatement perceptible. On ajoute au biogaz un liquide incolore à l'odeur caractéristique, le tétrahydrothiophène (THT), à hauteur de 15 à 40 mg/m3.
(v) GNV = Gaz Naturel pour Véhicules, et les véhicules l'acceptant.
Pour en savoir plus
(1) Volta sur Wikipédia
(2) Poubelle sur Wikipédia
(3) Histoire de la société TIRU
(4) Le Grenelle de l'environnement : quels engagements ? sur le site Vie-publique.fr
(5) FNADE Fédération nationale des activités de dépollution et de l'environnement
(6) Arrêté du 23 novembre 2011 fixant la nature des intrants dans la production de biométhane pour l'injection dans les réseaux de gaz naturel sur le site Legifrance.fr
(7) Biodéchets sur le site écologie.gouv.fr du ministère de la Transition écologique et de la Cohésion des territoires
(8) Effet de la méthanisation sur l’usage des sols et les systèmes de production PDF - F. Levavasseur, L. Boros, M. Carozzi, R. Girault, L. martin, P. Martin et S. Houot HAL open science, Effet de la méthanisation sur l'usage des sols et les systèmes de production (PDF), Florent Levavasseur, Léa Boros, Marco Carozzi, Romain Girault, Lucie Martin, et al., Webinaire CLIMAE « Quel impact de développement des énergies renouvelables sur l'usage des sols agricoles », Métaprogramme CLIMAE, May 2023, En Ligne, France. ⟨hal-04262845⟩
Parasport : les origines
La compétition sportive pour les personnes souffrant de handicaps physiques trouve son origine en 1948, lorsque le Dr. Guttmann, neurochirurgien britannique d’origine allemande, décide d'organiser les premiers « Jeux mondiaux des chaises-roulantes et des amputés », pour réinsérer psychologiquement ses patients paraplégiques, vétérans de la Seconde Guerre mondiale.
En 1952, cet événement prend une dimension internationale et, depuis les premiers Jeux paralympiques de 1960 qui se tiennent à Rome, une semaine après les J.O., les suivants se déroulent tous les 4 ans dans la ville choisie pour les Jeux olympiques.
Le handisport nécessite du matériel adapté, aussi bien pour les déplacements (prothèses de membres ou fauteuils roulants), que pour les accessoires spécifiques (sangles, ballons pour non-voyants, protections, etc.).
Les prothèses sont les dispositifs artificiels destinés à remplacer une partie amputée du corps, membre, portion de membre, articulation. Elles existent depuis l’Antiquité ! Jusque dans les années 1980, les athlètes handicapés ne portaient pas de prothèses spécifiques lors des compétitions sportives.
Par la suite, des prothèses spécialement conçues pour les parasports ont été développées. Elles doivent remplir plusieurs fonctions : légèreté, résistance mécanique, biocompatibilité, confort. Les matériaux et les conceptions utilisés dans les prothèses diffèrent selon le type de sport pratiqué.
Elles sont souvent faites sur mesure et privilégient l’efficacité plutôt que l’esthétique.
De quoi sont faites les prothèses des sportifs handicapés ?
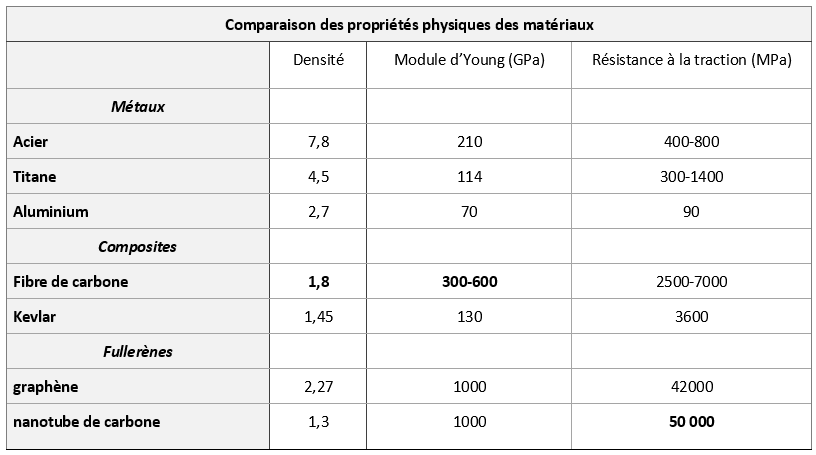
Les prothèses des blessés de la Première Guerre mondiale étaient en bois et cuir ! Désormais elles se caractérisent par des matériaux aux propriétés différentes. Les métaux comme le titane, l’aluminium ou l’acier, sont utilisés pour leur résistance et leur légèreté (en réalité ce sont des alliages acier inox, nickel-titane, etc.). Mais de nouveaux matériaux ont fait leur apparition comme la fibre de carbone, le kevlar, la fibre de verre, les matériaux composites, les silicones, etc. et ils ont largement modifié les performances des athlètes handicapés.
Oscar Pistorius, champion paralympique et olympique sur 400 m, utilise des lames en fibre de carbone, jouant le rôle de pied et de mollet. Sa « flex foot » est inspirée de la jambe arrière du guépard, le plus rapide des animaux.
Herr Hugh, grimpeur de très haut niveau dans les années 80, a créé des jambes prothétiques lui permettant d'escalader à nouveau après son accident. Dans son cas, le pied est en titane.
Ces prothèses sont aujourd’hui largement utilisées et résument bien l’apport des matériaux nouveaux.
Exemple d’une prothèse de membre inférieur
Elle comporte 3 éléments : l’emboîture, le manchon, la prothèse (fig. 1).

Figure 1. Flex foot. Source Brevet national des collèges 2020
https://lewebpedagogique.com/technopp/archives/640
1 - L’emboîture relie la prothèse au moignon (membre amputé), elle est la base sur laquelle se fixent les éléments de la prothèse, elle permet l’appui au moignon et transmet l’énergie du corps vers le « membre artificiel ».
Elle peut être réalisée avec un matériau composite (i) appelé « carbone tubulaire ». Ce sont des fibres de carbone (ii) imprégnées de résine acrylique (iii).
D’autres composites sont formés avec du Kevlar (iv), des fibres de verres ou de carbone, tous biocompatibles, qui permettent l’allègement de la prothèse et un meilleur aérodynamisme.
L'emboîture est conçue sur mesure pour éviter tout mouvement du moignon dans l'emboîture.
2 - Le manchon est l’interface entre la peau et l’emboîture, il est destiné à protéger le membre.
Partie souple de la prothèse, il est le plus souvent en silicone (v), matériau choisi pour son élasticité, sa biocompatibilité, sa durabilité et sa capacité à réduire les frottements et les irritations. Des copolymères ou du polyuréthane sont aussi employés.
3 - La prothèse elle-même, pied, genou, jambe, main… ne supporte pas les mêmes efforts selon le sport pratiqué.
Les « lames de course » constituant les prothèses des coureurs à pied sont désormais majoritairement en fibre de carbone.
En fait, les fibres de carbone tissées sont imprégnées de résine époxy et c’est ce matériau composite qui possède un ensemble de propriétés remarquables (cf. tableau comparaison) :
- légèreté due à la très faible densité de 1,8
- résistance 10 fois supérieure à celles de l’acier, ce qui donne une résistance spécifique 50 fois supérieure à celle de l’acier (quotient résistance /densité) (résistance à la compression et la traction, flexibilité)
- tenue en température
- longévité, due à l’inertie chimique (sauf à l’oxydation).
La fibre de carbone contribue au renforcement de nombreux composites. Mais sa production est complexe (vi) et la rend très coûteuse. La réparation et le recyclage des pièces sont problématiques.
Les avancées et les perspectives
Aujourd’hui de nouveaux composants électroniques révolutionnent l’efficacité des prothèses pour compenser le handicap.
Les progrès les plus innovants résident dans les prothèses bioniques (fig. 2) dans lesquelles un (ou plusieurs) composant(s) est géré électroniquement pour reproduire au mieux le fonctionnement humain. (bionique est la contraction de biologique et électronique).

Figure 2. Main bionique https://fr.motorica.org/blog
Des capteurs et des composants, conducteurs ou semi-conducteurs électroniques, captent l’activité (contraction-énergie) des muscles du membre résiduel et la transmettent à la prothèse.
Dans ce domaine, le graphène et les nanotubes de carbone, nouvelles formes (allotropes) du carbone de découverte récente, sont très prometteurs. Le graphène (vii) est constitué d’un feuillet d’atomes de carbone disposés sur un réseau de type nid d’abeille. Sa résistance à la rupture est deux cents fois supérieure à celle de l'acier (tout en étant six fois plus léger).
Un ou plusieurs feuillets peuvent s’enrouler pour former un nanotube de carbone (viii) (fig. 3).
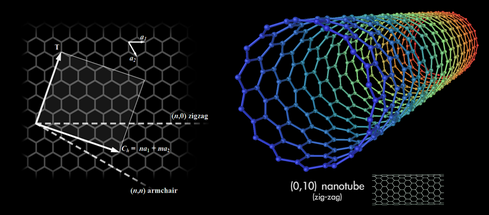
Figure 3. Nanotube de carbone.
Source : Mstroeck. Licence CC BY-SA 3.0, Wikimedia Commons
Flexibles et ultra-résistants, les nanotubes de carbone peuvent, entre autres propriétés, transmettre les courants électriques du corps humain, grâce à leur comportement métallique ou semi-conducteur. Ainsi la présence de nanotubes de graphène a-t-elle permis (1) de fabriquer des mains prothétiques fonctionnelles capables d'interagir avec des écrans tactiles (utile pour les sports électroniques !).
En conclusion, le temps de la jambe de bois du pirate est bien révolu ! L'évolution scientifique et technologique des prothèses permet maintenant aux sportifs handisports de pratiquer leur discipline à haut niveau.
Dans certains cas, les avancées technologiques donnent des capacités accrues aux athlètes handicapés, au point que leurs performances peuvent égaler voire devancer celles des sportifs valides. Par exemple la prothèse permet à l'athlète une restitution d'énergie plutôt constante (et donc moins de fatigue pour l’athlète). La lame de carbone d’un sprinter, selon sa conception ou sa longueur, donne à l’athlète une foulée plus longue et transmet une énergie supérieure à celle des athlètes non amputés. Peut-on alors parler d’« athlètes augmentés par la technologie » ?
Des questions éthiques sur la participation de ces athlètes au côté d’athlètes valides dans les compétitions internationales (2) existent déjà. Toutefois, au cours de l’histoire de l’athlétisme paralympique, seuls quelques athlètes ont atteint les performances des athlètes valides…
Andrée Harari et l’équipe question du mois
(i) Les matériaux composites sont constitués de deux ou plusieurs composants dont les propriétés, différentes mais complémentaires, confèrent au composite des caractéristiques spécifiques.
Dans le cas présent ils présentent, pour l’application recherchée, les avantages suivants :
- résistance : le matériau supporte de nombreux chocs et pressions externes grâce au renfort des fibres de carbone,
- volume et masse plus faibles : allègement parfois considérable du produit final,
- durée de vie : du fait de sa résistance et sa relative inertie chimique, le matériau est durable.
(ii) La fibre de carbone est constituée de fibres extrêmement fines (5 à 10 microns de diamètre) d’atomes de carbone agglomérés en microcristaux. L’alignement des cristaux le long de l’axe de la fibre la rend très résistante. Plusieurs milliers de fibres de carbone sont enroulées ensemble pour faire un fil. Les fibres de carbone étant formées de domaines graphitiques, elles présentent les propriétés électriques du graphite.
Cependant les propriétés sont unidirectionnelles, (anisotropie). Ce n’est pas le cas des métaux qui sont capables de supporter des charges dans n’importe quelle direction (propriété isotrope).
(iii) Une résine acrylique est un polymère thermoplastique ou thermodurcissable obtenu à partir d'acide acrylique (H2C=CHCOOH), ou autres composés apparentés. Ses propriétés utiles sont la résistance mécanique, la biocompatibilité, la transparence.
(iv) Le Kevlar (nom commercial du poly(p-phénylènetéréphtalamide) (PPD-T) est un polymère thermoplastique constitué de noyaux aromatiques séparés par des groupes amide. Les liaisons hydrogène lui confèrent son exceptionnelle résistance spécifique (rapportée à la densité), supérieure à celle de l'acier, mais inférieure à celle des fibres de carbone.
Comme les autres fibres textiles, il ne fait pas partie des matières plastiques (fig. 5).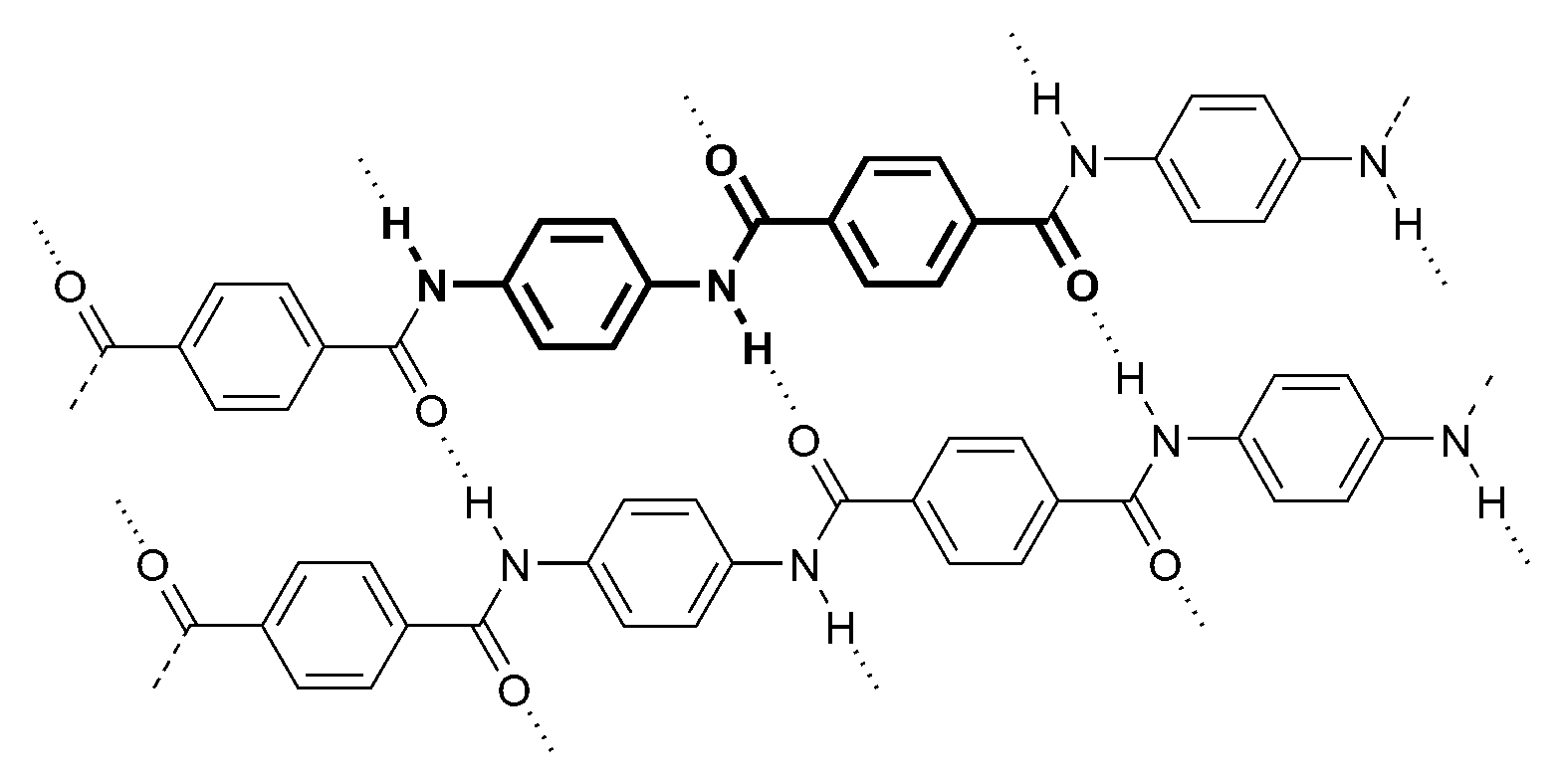
Structure du kevlar. Licence CC BY-SA 3.0, Wikimedia Commons
(v) Les silicones, ou polysiloxanes, sont des composés inorganiques (il n’y a pas d’atomes de carbone dans la chaîne principale) formés d'une chaîne silicium-oxygène dans laquelle des groupes se fixent sur les atomes de silicium. Le type le plus courant est le polydiméthylsiloxane linéaire (PDMS).
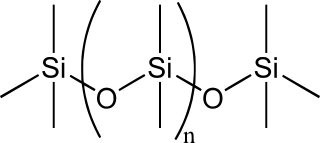
PDMS. licence CC BY-SA 3.0, Wikimedia Commons
Si l'on fait varier les chaînes, les groupes fixés et les liaisons entre chaînes, les silicones fournissent une grande variété de matériaux dont la consistance varie du liquide au plastique dur, en passant par le gel.
(vi) La fibre de carbone est fabriquée à partir des précurseurs comme :
- Les fibres de polyacrylonitrile (fibres de PAN de formule H2C=CH–C≡N). Ces dernières sont oxydées vers 200-300°C pendant une durée allant de 30 minutes à 3 heures et deviennent infusibles. Ces fibres sont ensuite carbonisées sous atmosphère inerte entre 1 000 °C et 1 500 °C pour éliminer les éléments H, N, et O. La graphitisation par un second traitement thermique à haute température (plus de 2 000 °C) améliore la structure des fibres.
- Le brai, goudron issu de distillation de résidus de pétrole ou de houille.
- La cellulose.
(vii) Le graphène est un composé bidimensionnel cristallin, identifié en 2004.
Cette forme de carbone, correspond à un feuillet unique de graphite, de réseau hexagonal, type nid d’abeille. Ses propriétés sont donc bidimensionnelles :
- résistance à la rupture deux cents fois supérieure à celle de l'acier (tout en étant six fois plus léger)
- exceptionnelles conductivités électrique et thermique
- durabilité

Structure du graphène. Domaine public, Wikimedia Commons
(viii) Un nanotube de carbone, observé pour la première fois en 1991 (4) (5), est une structure cristalline composée d'atomes de carbone qui peut être décrite comme un feuillet de graphène enroulé sur lui-même. C’est un tube creux, de diamètre interne d’environ un nanomètre (10-9 m) et d’une longueur de l'ordre de quelques microns.
Les nanotubes peuvent être mono-feuillet ou multi-feuillets. La structure d'un nanotube de carbone multi-feuillets correspond soit à plusieurs feuillets de graphène concentriques, soit à un seul feuillet de graphène enroulé sur lui-même de façon hélicoïdale.
Du point de vue électrique, les nanotubes mono-feuillets ont la particularité remarquable d’être soit métalliques (conducteurs) soit semi-conducteurs. En outre ils ont une excellente rigidité (mesurée par le module de Young), comparable à celle de l'acier et une extrême légèreté.
Références
(1) Nanotubes de graphène, sur le site Motorica (2021)
(2) Le sport augmenté, une révolution en marche à autoriser ?, Journée Transhumansime : de nouveaux droits, Mai 2021, Aix-en-Provence, France, M. Lahaye, V. Perkins, Ch. Charleux, G. Nicolas, V. Andrieu et A. Mahalatchimy, halshs-03406451v2
(3) Electric Field Effect in Atomically Thin Carbon Films K. S. Novoselov, A. K. Geim, S. V. Morozov et al., Science, vol. 306, n° 5696 (2004) p. 666–669
(4) Helical microtubules of graphitic carbon, S. Iijima, Nature, 354 (1991) p. 56-58.
(5) Who should be given the credit for the discovery of carbon nanotubes? M. Monthioux et V. L. Kuznetsov, Carbon, vol. 44, n°9 (2006) p. 1621-1623
Pour aller plus loin
* Les nouvelles prothèses Serge Lécolier, Revue Chimie Paris, n°338-339 (2012) p. 8-11
* Handicap et évolution scientifique et technologique : la prothèse dans le handisport (PDF) Comité Départemental Olympique et Sportif de l'Aisne, aisne.franceolympique.com
* Société Össur, fabricants de produits orthopédiques non invasifs
* Cours de physique du solide : les nanotubes de carbones (pdf) sur le site de l'Institut Rayonnement-Matière de Saclay (Iramis) - CEA
* Cette main bionique peut fonctionner plusieurs années, R. Fouchard, News de science (2023) sur le site des Techniques de l’Ingénieur
* Prothèses bioniques : retrouver les fonctions perdues, article réalisé avec M. Maier, de l'École des neurosciences (unité FR3636), CNRS - Université Paris Descartes, Site de la Fondation pour la Recherche Médicale
Crédit illustration : Championnats du monde d'athlétisme IPC 2013. 200 mètres féminin T44. De gauche à droite : Sophie Kamlish (GB), Marie-Amelie Le Fur (France), Marlou van Rhijn (Netherlands)
Fanny Schertzer, licence CC BY-SA 3.0, Wikimedia Commons
Les beaux jours approchent et vous voulez profiter de votre piscine. Il faut donc s’assurer que son eau est saine et propre à la baignade. Et vous allez faire de la chimie sans vous en rendre compte !
L’eau dans les piscines doit avoir les caractéristiques suivantes :
- abiotique, donc aucun organisme vivant (autre que les baigneurs !),
- limpide,
- non agressive pour les baigneurs.
Quels sont les organismes vivants concernés ? Il s'agit de microorganismes (bactéries, virus, champignons...) et d'algues. Pour lutter contre ces organismes, il est nécessaire de désinfecter l’eau par l’acide hypochloreux, ClOH.
Le traitement le plus rencontré utilise des « galets de chlore »
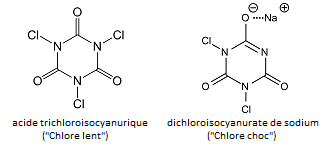
L’acide hypochloreux, ClOH, est généré in situ en introduisant des « galets de chlore » dit « lents » et « chocs » qui sont deux composés voisins, l’acide trichloroisocyanurique (TCU) et le dichloroisocyanurate de sodium (DCU) (i).
La réaction mise en jeu (par exemple pour le TCU) est : TCU + 3 H2O = 3 ClOH + acide isocyanurique (ii)
Dans les documents commerciaux, ClOH est surnommé « chlore actif ».
Le « chlore lent », peu soluble dans l’eau, permet une dissolution progressive du galet et donc une concentration faible et continue en ClOH. Pour une piscine de 55 m3, il faut deux galets de 250 g pour 7 à 10 jours.
Le « chlore choc » se dissout très rapidement permettant d’augmenter très vite, si nécessaire, la concentration en ClOH (en cas de problème d’algues ou à la sortie de l’hivernage, par exemple).
Il peut arriver qu’on observe une accumulation d’acide isocyanurique au cours du temps. Si sa concentration est trop élevée, les galets n’agissent plus. On dit alors que la piscine est « saturée ». À noter que l’acide isocyanurique est inoffensif pour la baignade (iii). Pour éviter la saturation il faut vidanger une partie de l’eau (environ 1/3) avant chaque hivernage, l’appoint sera apporté par l’eau de pluie avec éventuellement un peu d’eau du robinet.
Pour éliminer les algues, il faut ajouter des sels d’ammonium quaternaire, en combinaison avec du « chlore choc ». Un exemple de sel d’ammonium est donné en note (iv). La prolifération des algues, qui contribuent à une eau trouble et verdâtre ainsi qu’à des dépôts rendant les surfaces glissantes, est favorisée par la lumière, par une augmentation de la température et par une élévation du pH.
La régulation du pH, le plus proche de 7,2, est indispensable pour trois raisons.
- D’une part pour que l’eau ne soit pas agressive pour la peau, il faut que le pH soit compris entre 7,2 et 7,6.
- D’autre part, l’acide hypochloreux est en équilibre dans la solution avec les ions hypochlorite ClO-. Or le pouvoir destructeur des microorganismes de l’acide hypochloreux est environ 100 plus fort que celui des ions hypochlorite [1] et la teneur en acide hypochloreux chute de 66 % à 50 % lorsque le pH augmente de 7,2 à 7,5.
- Enfin il ne faut pas que le pH devienne trop acide car un dégagement de dichlore pourrait se produire (v). Ainsi, si le pH devient inférieur à 7,2, on ajoute du carbonate de sodium Na2CO3, appelé commercialement « pHplus ».
Pour avoir une eau limpide on ajoute du sulfate d’aluminium. Il permet d’agréger (vi) les particules en suspension et de faciliter la filtration ultérieure. Les galets commerciaux (environ 100 g) de ce composé sont enfermés dans un sachet non-tissé ayant l’apparence d’une chaussette. Un résidu gluant se forme dans la « chaussette » évitant d’encrasser les canalisations.
L’acide hypochloreux détruit les microorganismes mais se combine aussi aux composés organiques azotés tels que la sueur, les peaux mortes… que peuvent apporter les baigneurs et baigneuses, pour donner des chloramines ou des composés encore appelés « chlore combiné ». D’où la douche savonnée et le shampoing fortement recommandés en amont. Ces chloramines sont lacrymogènes, d’où la sensation d’avoir les yeux qui piquent, et ont une forte odeur attribuée par erreur « au chlore ». La consommation de ClOH par ces composés diminue la quantité de ClOH disponible pour éliminer les microroganismes. Si c’est le cas, il faut donc augmenter la concentration en acide hypochloreux.
Pour éliminer les chloramines il est nécessaire d’aérer et de renouveler partiellement l’eau de la piscine.
Le traitement par électrolyse
Il existe un autre mode de traitement des eaux de piscine, vendu sous les noms de « piscine au sel » ou « électrolyse au sel » ou « désinfection au sel ». Ce procédé est souvent présenté comme « plus écologique que le chlore » ou « traitement naturel donc plus écologique ». On lit aussi que ce procédé n’utilise pas de « chlore chimique » mais du « chlore naturel » !
Alors tout d’abord soyons clair, ce n’est pas le sel qui désinfecte l’eau de la piscine comme pourraient le faire croire certaines publicités, c’est toujours l’acide hypochloreux ClOH ou « chlore actif ». Et bien sûr c’est la même molécule chimique que celle obtenue avec les « galets de chlore ».
Comment ça marche ?
On introduit 3 à 6 g de chlorure de sodium (vii), NaCl, par litre d’eau de la piscine. Cette concentration est environ 6 à 11 fois moins concentrée que celle de l’eau de mer.
Un électrolyseur est un appareil présentant une cellule d’électrolyse comportant deux plaques en titane (ce sont les électrodes) et un système électrique permettant de créer une différence de potentiel constante (comme un générateur de courant continu). L'eau salée de la piscine est alors pompée à travers le système de filtration et acheminée jusqu'à la cellule d'électrolyse après être passée par les sondes d’analyses, le surpresseur et le réchauffeur. On crée une différence de potentiel (basse tension) entre les 2 électrodes ce qui provoque le passage d’un courant électrique qui va engendrer une réaction chimique à chacune des électrodes.
À l’anode il y a l’oxydation des ions chlorure en acide hypochloreux (viii). On a donc créé in situ le même composé qu’avec les « galets lents et chocs ». Il a bien sûr les mêmes propriétés de désinfection et d’élimination des microorganismes et des algues.
À la cathode, l’eau est réduite en dihydrogène (ix). Ce dihydrogène est entrainé dans le flux (on peut observer des bulles dans l’eau à proximité de la cellule d’électrolyse).
Donc l’électrolyse de l’eau salée a pour réaction globale : 2 H2O + Cl- → ClOH + H2 + OH-.
La réaction globale faisant apparaitre globalement des ions OH-, il est toujours indispensable, de contrôler le pH. Aussi les installations sont souvent proposées équipées d’un régulateur automatique de pH utilisant de l’acide sulfurique.
Lors de la réaction de ClOH sur les microorganismes, il est réduit en chlorure, Cl-, ce qui régénère le sel. C'est ainsi un cycle fermé.
Il faut toutefois surveiller régulièrement la concentration en sel et l’ajuster en cas de dilution par la pluie ou si l’eau de la piscine a été renouvelée ou s’il y a formation de chloramines qui consomment ClOH ce qui casse en partie ce cycle.
Les rayons ultraviolets (UV) provoquant une destruction photochimique de ClOH selon 2 ClOH → O2 + 2 H+ + 2 Cl-, cela rend plus difficile de maintenir le taux de « chlore actif » dans une piscine en plein air. Il faut donc aussi adapter la production par électrolyse au fait que la piscine soit couverte ou non.
L’état des électrodes joue un rôle important sur l’efficacité de la production de ClOH. En particulier leur durée de vie sera affectée si l’eau est très calcaire (ou dite « dure »). Les électrodes sont parfois proposées avec inversion de polarité possible pour alterner leur rôle d’anode ou de cathode et empêcher des dépôts de tartre (calcaire CaCO3).
Enfin le sel favorise la corrosion des installations, ce qui est à prendre en compte dans le coût d’entretien.
Françoise Brénon
(i) Le nom « acide trichloroisocyanurique » est impropre car ce n’est pas un acide. Son nom officiel est le 1,3,5-trichloro-1,3,5-triazinane-2,4,6-trione). Les formules développées sont :
(ii) L’acide iso cyanurique a pour formule développée
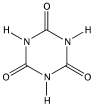
(iii) L'acide cyanurique est classé comme « essentiellement non toxique ». Seule donnée sur la toxicité de l’acide isocyanurique : néphrotoxique chez l’animal si ingéré en grande quantité https://reptox.cnesst.gouv.qc.ca/Pages/fiche-complete.aspx?no_produit=11965
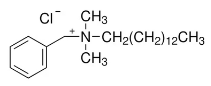
(iv) Exemple : Le chlorure de benzalkonium est un mélange de chlorures d’alkylbenzyldiméthylammonium, de formule générale [C6H5-N+(CH3)2CH2 R] Cl-, R représentant des radicaux « alkyl » de C8 à C18. Il est généralement répertorié dans la
littérature sous le numéro CAS n° 8001-54-5.
Exemple du plus couramment employé :
(v) Selon la réaction ClOH + Cl- + H+ → Cl2 + H2O. le dichlore formé est un gaz très toxique.
(vi) En effet si les particules sont très fines (< 20-40 µm) elles ne sont pas éliminées par le filtre à sable. Le phénomène en présence de sel d’aluminium est appelé floculation. Les ions Al3+ donnent un hydroxyde hydraté colloïdal Al(OH)3, x(H2O) agrégeant les particules en suspension, facilitant une filtration ultérieure.
(vii) Se reporter sur la notice du constructeur de l’appareil. Et on peut regarder des conseils en ligne.
(viii) Selon Cl- + H2O → ClOH + H+ + 2 électrons
(ix) Selon 2 H2O + 2 électrons → H2 + 2 OH-
Pour en savoir plus
[1] L'eau de Javel : sa chimie et son action biochimique, G. Durliat, J.L. Vignes et J.N. Joffin. BUP n° 792 (1997) pp. 451-469 et tout particulièrement pages 462-464 où est expliqué le rôle du pH et le pouvoir bactéricide de l’acide hypochloreux supérieur à celui des ions hypochlorite.
[2] Le traitement des eaux de piscine, collection Techno, Nathan (1987)
[3] Guide-piscine 2015, SIET, guide de bonnes pratiques, issu de travaux menés par l'ensemble des professionnels du traitement et de l'analyse des eaux de piscines. Concerne plus particulièrement les piscines collectives.
[4] Pour les piscines avec électrolyseurs on peut consulter les notices des constructeurs. Par exemple Distripool, ou Sterilor ou Dytech…
Crédit illustration : OceanProd / Adobe Stock
Rencontres régionales, nationales, européennes, coupes du monde et bientôt les Jeux olympiques à Paris, que d’occasions pour se retrouver dans les stades. Mais un stade est source de pollution comme tout lieu public accueillant un grand nombre de personnes. De plus en plus d’installations sportives relèvent avec succès le défi climatique en intégrant de nouveaux dispositifs très prometteurs. Découvrons quelques solutions pour rendre un stade plus écologique.
Un constat : les chiffres sont impressionnants (1) (2)
L’arrosage des pelouses consomme énormément d’eau : cela représente près de 100 millions de m3 chaque année en France. La consommation électrique est de 100 000 kWh pour l'éclairage d’un stade pendant un match.
L’émission de dioxyde de carbone CO2 est considérable et concerne aussi bien celui généré pour fabriquer le béton utilisé pour la construction et les rénovations que celui émis pour les transports des supporters lors de chaque rencontre. Par exemple, « En prenant en compte les infrastructures, l’Euro 2016 en France, a de son côté engendré l’émission de 2,8 millions de tonnes de CO2e (i), avec 80% des émissions liées aux stades et un peu moins de 20% liées aux spectateurs. » (2)
Des solutions existent en repensant la nature des pelouses, les matériaux de construction, les transports, la gestion du stade, la limitation des déchets et même en faisant des médailles recyclées ! Nous citerons ici deux exemples où la chimie peut participer à cette amélioration.
Les pelouses hybrides
Il existe plusieurs natures de sols sportifs :
- les sols classiques composés de terre et de sable, qui concernent surtout les clubs amateurs,
- les pelouses naturelles,
- les pelouses artificielles à base de matériaux plastiques,
- les sols hybrides qui concernent depuis 15 ans tous les terrains pour les compétitions de haut niveau.
Apparu en 1990 le gazon hybride est constitué de plusieurs matériaux : du gazon naturel, des fibres de gazon synthétique et un substrat.
Ce gazon hybride, développé par la technologie AirFibr est donc constitué d'un gazon naturel, enraciné dans un substrat de synthèse breveté composé de granulés de liège, de microfibres synthétiques (1 % de la masse de gazon) et de sable fin. Le sable est le composant majoritaire du substrat.
Les microfibres synthétiques renforcent l'enracinement du gazon. Ces microfibres sont généralement faites de polyéthylène (PE), de polypropylène (PP) ou de polyamide (PA) partiellement renforcé de fibres de verre. Elles se présentent sous forme de mono-filaments ou elles sont « fibrillisées » afin de simuler les brins de gazon naturel et de mieux stabiliser les granulats de remplissage. L’insertion des fibres est maintenue en place par une deuxième base qui est faite de latex ou de polyuréthane. Les granulés de liège absorbent les chocs et réduisent les risques de blessure des joueurs (3).
Un terrain hybride améliore la vitesse de jeu, la transmission du ballon, la souplesse de la pelouse et rend le terrain praticable par tous les temps. Le drainage est immédiat, l’eau est absorbée très rapidement et l’évaporation est retardée. Ainsi, le terrain n’est jamais inondé, comme cela peut être le cas avec de la pelouse naturelle.
Ces pelouses peuvent aussi bien être engazonnées par semis que par rouleaux de placage. La surface de jeu homogène reste plane et stable, quelles que soient les conditions climatiques.
L'avantage de cette dernière technique offre aux stades une flexibilité dans la gestion du terrain. En effet, en moins d'une semaine, la pelouse est changée et jouable. Grâce à ce délai court entre le placage et l'accueil d’un match, il est désormais possible de multiplier le taux d'utilisation des stades, notamment en mutualisant le terrain (football et rugby), en accueillant des événements socio-culturels (concerts, festivals) tout au long de l’année. Ceci permet donc de diminuer le nombre de bâtiments avec en conséquence des économies multiples.
Remarque concernant les pelouses artificielles
L’utilisation de billes de pneu recyclés en tant que substrat pour un terrain synthétique, qui permet une utilisation plus intensive comparée à la pelouse et de réaliser une substantielle économie d’eau et d’entretien, est soumise depuis 2018 à une réglementation européenne (4) imposant une très faible teneur en HAP (Hydrocarbures aromatiques polycycliques). La Commission européenne a décidé en 2023 de les interdire à partir de 2031. Reste encore à trouver les solutions de remplacement (5).
Et des médailles à partir de téléphones portables recyclés !
Les médailles de la Coupe du monde de rugby disputée en France en 2023, en or, argent et bronze (alliage majoritairement composé de cuivre et d’étain) ont été fabriquées à partir de téléphones portables recyclés. Ce procédé a déjà été utilisé aux JO de Tokyo en 2021.
Pour cela 206 000 appareils ont été récoltés dans les clubs de rugby et 1491 médailles ont été frappées à la Monnaie de Paris. Le recyclage a été fait dans l’entreprise WeeeCycling [6], située en Normandie, affineur ne travaillant qu’à partir de déchets sans utiliser de minerai d’extraction. Des traitements chimiques et thermiques des déchets électriques et électroniques permettent d’en extraire des métaux précieux et stratégiques à très haut niveau de pureté, moyennant des émissions de CO2 « jusqu’à 2000 fois plus faibles que celles des procédés miniers ».
Après broyage et séparation mécanique, les déchets passent dans des fours permettant de former un alliage séparé des impuretés et des métaux communs, grâce à des réactions d’oxydo-réduction par voie thermique. Les métaux communs sont valorisés par ailleurs. Ces processus n’utilisent que des déchets et leurs pouvoirs calorifiques sont utilisés de manière optimisée avec une faible consommation énergétique (1500 à 2000 fois plus faibles que les procédés miniers traditionnels). La purification de chaque métal est obtenue par différentes phases de séparation et d’affinage chimique et électrochimique.
Ainsi, pour un téléphone de masse égale à 100 g, on obtient 25 mg d’or, 0,34 g d’argent, 8 g de cuivre et environ 1 g d’étain (6) (7a) (7b).
Quelques exemples de réalisations et de projets
Le stade de football de Rodez (8) est équipé d’une pelouse hybride. Un système composé d’arroseurs disposés de manière régulière sur l’ensemble du terrain permet une répartition optimale de l’eau et un arrosage rapide juste avant le match ou pendant la mi-temps, pour humidifier le terrain.
Le système d’arrosage est relié à un système de gestion centralisée lui-même relié à une station météo. Des sondes d’humidité fournissent des informations complémentaires au système sur l’air, l’humidité, les précipitations et le sol, permettant de réajuster la programmation de l’arrosage et d’apporter à la plante la juste quantité d’eau dont elle a besoin. Le terrain a été livré en octobre 2019. M. Rouquié, directeur des sports de la ville de Rodez précise qu’ « avec ce terrain hybride, les apports en eau sont plus fréquents mais moins importants et que la consommation en eau est passée de 5000 m3 à 3000 m3 ».
Un stade de football à Saint-Pol-sur-Mer, dans le Nord, vient d'être équipé d’une pelouse Mixto® de type hybride très drainante par l’entreprise idverde, pour un coût intermédiaire entre celui d’un revêtement conventionnel totalement en herbe et celui d’une pelouse hybride classique (9).
À Lyon, au Groupama Stadium, 50 000 m2 de panneaux solaires ont été installés dans son complexe d’activités pour couvrir une partie des besoins en électricité de l’enceinte (10).
En 4ème division anglaise, le club de Forest Green Rovers promet, d’après le journal La Croix du 15 novembre 2022, de « construire le stade le plus écologique du monde » (prévu pour 2025 avec 5000 places). Il sera entièrement composé de bois, le stade sera alimenté par des sources d’énergie renouvelable (panneaux solaires) et les pelouses seront hybrides sans pesticide. À suivre donc !
Enfin, pour l’ensemble des stades, les pelouses conventionnelles étant très régulièrement et longuement arrosées avant les matchs, on pourrait réutiliser l’eau de pluie.
Odile Garreau et l’équipe question du mois
(i) La notation CO2e est relative aux équivalents dioxyde de carbone qui sont une mesure de l'effet des différents gaz à effet de serre (GES) sur le climat. https://www.connaissancedesenergies.org/questions-et-reponses-energies/gaz-effet-de-serre-quest-ce-que-l-equivalent-co2
(ii) chiffres donnés avant l’installation de la station météo
Sources et Pour en savoir plus
(1) Euro 2016 : l’empreinte écologique démesurée du football en question, C. Fournier, Media youmatter.world
(2) Foot et climat : le bilan carbone du ballon rond, entreprise SAMI Plateforme climat Consultant carbone
(3) Pelouse hybride augmentée AirFibr, société Natural Grass, travail de recherche et développement réalisé en partenariat avec l'Institut de Biomécanique Humaine des Arts et Métiers ParisTech.
(4) Restriction guideline: Annex XVII entry 50, paragraphs 5 and 6 on PAHs: articles within or excluded from the scope, ECHA europa.eu
(5) Enquête Interdiction du pneu sur les terrains synthétiques : les Villes vont payer plus cher, actu.fr
(6) Les spécialités de traitement des déchets de la société WeeeCycling et Processus de transformation de la société WeeeCycling
(7a) Pourquoi ne faut-il pas jeter son smartphone hors d’usage ? F. Brénon, Question du mois, Mediachimie.org
(7b) Projet THYMO | Recyclage des métaux contenus dans les cartes électroniques des téléphones portables GeoRessources, TJFU, Institut Carnot ICEEL, CNRS Centre Est
(8) Stade de football de Rodez : Irrigation spécifiques des terrains hybrides,F. Martin, article de Irrigazette, The leading International Irrigation magazine
(9) idverde invente une pelouse sportive hybride très résistante, Stanislas du Guerny, article de Les Echos 25/10/2016
(10) L’équivalent de 7 terrains de foot ! OL Vallée en passe d’accueillir 50 000 m2 de panneaux photovoltaïques, Lyon Entreprises.com
Crédit illustration : image par Pexels / Pixabay