On trouve toutes sortes de recettes dites « de grand-mère » sur Internet pour nettoyer son argenterie. Dans ces dites recettes il est même précisé « sans utiliser de produit chimique » !!! Est-ce vrai ?
D’où provient le noircissement de l’argent ?
Les aliments contiennent naturellement des sulfures comme l’albumine du blanc d’œuf, la cystéine présente dans les protéines, des sulfures organiques dans les choux, les oignons, certaines boissons…
Dans l’air il peut y avoir des traces de sulfure d’hydrogène (H2S, reconnaissable à son odeur « d’œuf pourri » !) et de sulfure de diméthyle (H3C-S-CH3) qui est le plus abondant des composés biologiques contenant du soufre émis dans l'atmosphère.
C’est ainsi la présence de ces sulfures qui sont majoritairement responsables de la formation de dépôts noirâtres à la surface d’un objet en argent. L’argent a été oxydé par le dioxygène de l’air et en présence de ces sulfures s’est recouvert de sulfure d’argent Ag2S, noir, très stable (1).
« Faire l’argenterie » consiste donc à éliminer ce sulfure d’argent.
Une recette : « Nettoyer son argenterie dans un bain de sel ».
Élucidons cette « recette de grand-mère » dont le titre interpelle le chimiste ! En effet ce titre est trompeur ! Ce n’est pas le sel qui nettoie l’argenterie.
Regardons de plus près la recette. Prendre une feuille d’aluminium. La disposer dans une cuvette en plastique (éviter un autre métal). Mettre une poignée de gros sel dans une casserole d’eau que l’on porte à ébullition. Puis verser cette eau salée chaude dans la cuvette. Introduire délicatement (sans se brûler) l’objet en argent à nettoyer et le poser au contact de la feuille d’aluminium. Laisser agir plusieurs minutes à 1 heure selon l’état d’oxydation de l’argent. Il est précisé que si l’objet en argent est très noir, on peut l’envelopper avec la feuille d’aluminium pour plus d’efficacité. Il est aussi dit que l’on peut ajouter du bicarbonate. Rincez puis séchez avec un chiffon très doux.
Notons que cette recette fonctionne bien.
Alors quels rôles jouent ces différents ingrédients ?
Le composé essentiel à la réussite de l’opération est ici l’aluminium. C’est un métal très réducteur. Il attaque le sulfure d’argent qui était un état oxydé de l’argent. L’argent est régénéré. Une partie de l’aluminium s’oxyde en ions Al3+. Compte tenu du pH de la solution ces ions précipitent sous forme d’hydroxyde d’aluminium, à la surface de l’aluminium qui se ternit.
La réaction (2) mise en jeu est
3 Ag2S + 2 Al +6 H2O → 6 Ag + 2 Al(OH)3 + 3H2S
On est en présence d’une pile (3), la pièce en argent étant au contact de la feuille d’aluminium. Si l’on enveloppe la pièce en argent par l’aluminium le contact entre les 2 métaux est meilleur facilitant ainsi les échanges d’électrons entre l’aluminium et le sulfure d’argent déposé sur l’objet en argent.
Quel est le rôle du sel ? Le sel est du chlorure de sodium (NaCl) qui se dissout sous forme d’ions sodium (Na+) et chlorure (Cl-). Il favorise les transports des ions (4) en solution mais n’intervient pas dans le bilan chimique.
La chaleur a pour but d’accélérer la réaction.
H2S : si vous avez déjà fait l’expérience, vous avez constaté l’émanation d’une mauvaise odeur. Elle est due à la formation du sulfure d’hydrogène produit durant la réaction et dont le dégazage est favorisé par la chaleur.
L’ajout éventuel du bicarbonate de sodium permet de stabiliser le pH vers 8,3 ce qui limite le dégazage de H2S.
Précautions
- Prenez soin de ne pas traiter de la même façon un bijou en argent avec des pierres fines incrustées. Ce mode opératoire ne concerne que des objets et bijoux en argent massif ou des couverts argentés (5).
- D’autres recettes proposent d’ajouter du vinaigre et non du bicarbonate. C’est à éviter car cela favorise la formation de H2S.
- Dans tous les cas aérer la pièce lors de ces manipulations.
Autres méthodes
- Frotter avec du carbonate de calcium ou avec une pâte de bicarbonate et de gros sel à confectionner soi-même. Il s’agit alors seulement de frotter et d’abraser la surface pour éliminer les traces de sulfures d’argent. Cela ne peut convenir qu’à des objets peu noircis et ne permet pas d’éliminer les traces restantes de sulfure d’argent piégés dans les micropores de la surface de l’objet.
Outre la faible efficacité, les risques sont de rayer l’argent qui est un métal assez mou et qui gardera les traces de ces rayures bien que les grains de bicarbonate et de gros sel soient estimés comme pas trop durs. De manière générale il vaut mieux éviter de frotter les objets en argent.
- Frotter avec une brosse à dent trempée préalablement dans du jus de citron : toujours abraser avec risque de rayures et de toute façon le citron n’est pas un acide capable de dissoudre Ag2S.
- Les professionnels de la restauration des objets d’art, de la bijouterie et des restaurants utilisant des couverts en argent pour leurs clients sont amenés à entretenir très souvent l’argenterie. Ils utilisent des produits à action très rapide dans lesquels ils les trempent. Le principe actif est alors la thio-urée qui réagit sur le sulfure d’argent l’éliminant ainsi de la surface de l’argent (6). Un rinçage soigneux termine l’opération. Il est indispensable de manipuler ces produits avec des gants et de porter des lunettes afin d’éviter tout contact avec la peau et les yeux.
Françoise Brénon et l’équipe question du mois
(1) En présence de sulfure d’hydrogène et d’oxygène de l’air, le sulfure d’argent noir, très stable, se forme selon
4 Ag + 2 H2S + O2 →2 Ag2S + 2 H2O
(2) Cette réaction est très favorable car sa constante d’équilibre vaut 10140 >>1
Les données nécessaires à ce calcul, E° (Ag+ / Ag) = 0,80 V ; E° (Al3+ / Al) = - 1,66 V ; pKs (Ag2S) = 49,2 ; pKs (Al(OH)3) = 33 ;
H2S : pKa,1 = 7,05, pKa,2 = 12,9 ; pKe = 14, sont issues de Les réactions chimiques en solution de G. Charlot (Masson).
(3) L’aluminium est le pôle négatif, c’est l’anode où se passe l’oxydation :
Al + 3 H2O → Al(OH)3 + 3 H+ + 3e-
Le pôle positif est constitué du sulfure d’argent déposé sur l’argent. Il s’y passe la réduction :
Ag2S + 2 H+ + 2e- → 2Ag + H2S
(4) Le sel dissout joue ici le rôle de l’électrolyte de la pile.
(5) Les couverts dit « en argent » sont rarement en argent massif. Ils sont en général en cuivre ou alliage de cuivre sur lequel a été déposé une fine couche d’argent.
(6) La thio-urée, notée de façon simplifiée Tu, a pour formule H2N-CS-NH2.
Si le mode opératoire est utilisé depuis le milieu du 20e siècle, la réaction mise en jeu suscite encore des questions. D’après les publications les plus récentes il est proposé 3 types d’interprétation :
- Soit une complexation (écrite ici en milieu acide) mettant en jeu la formation d’un complexe mononucléaire de Ag(I) selon
Ag2S + 2H+ + 2n Tu → 2 AgTun+ + H2S, n pouvant aller de 1 à 4. - Soit la formation d’un complexe binucléaire de l’Ag(I) selon
Ag2S + 2H+ + n Tu → Ag2Tun2+ + H2S, n allant de de 1 à 6 avec une forte présomption pour la forme majoritaire Ag2Tu42+. - Soit enfin la formation d’un composé éliminant Ag2S de la surface de l’argent selon
Ag2S + 2 CS(NH2)2 → 2 Ag-S-S-C(NH2)2
Sources :
- Métallurgie de l’argent § 6.2.1. in Les Techniques de l’Ingénieur (2006) et Silver and Acid-thiourea Silver Dips: Rinsing and Aging Monitored by Electrochemistry, L.Selwyn et W. R. McKinnon, Studies in Conservation (2021) 66:2, 98-112
- Potentiometric study of silver complexes with thiourea in acid media, P. Lukinskas et al. , Journal of Coordination Chemistry (2008) 61:16, 2528-2535
- Reaction of Thiourea With Silver Sulfide Tarnish Layers On Silver Surfaces, Ariga Allehyari (Californie State University, 2020)
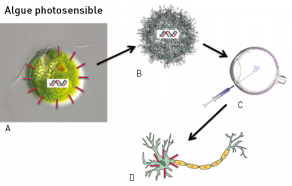
Les chercheurs de l’Institut de la vision (1) avec le professeur Jean Alain Sahel, l’Institut d’ophtalmologie de Bâle et le concours d’une start-up GenSight Biologics viennent de réussir récemment une performance clinique sur un patient aveugle. Depuis plusieurs années ils ont développé la thérapie « optogénétique » afin de redonner la vue à des patients devenus aveugles.
Cette approche thérapeutique nous avait déjà été signalée et décrite en 2017 lors du colloque « La chimie et les sens » à la Maison de la Chimie par le docteur Serge Picaud de l’INSERM (2). Cette incroyable innovation repose sur l’utilisation du système photosensible d’une algue unicellulaire qui est capable de se déplacer vers une source de lumière. Le principe de base est dû à une protéine qui sous la perception de la lumière ouvre un canal ionique dans la cellule et produit donc un courant qui agit sur le déplacement de l’algue (3). Les chercheurs, par biochimie, ont réussi à extraire le code génétique de cette protéine de la membrane des algues, à l’aide d’un vecteur viral de type virus adéno-associé (AAV) classiquement utilisé en thérapie génique. Ce vecteur est injecté dans l’œil, il diffuse dans la rétine et pénètre les neurones résiduels. Il a été montré que cette protéine photosensible est alors exprimée dans les cellules ganglionnaires de la rétine qui peuvent ainsi envoyer des signaux aux neurones du cerveau en fonction de l’intensité lumineuse reçue. Après des essais menés sur des souris puis sur des primates, les premiers essais cliniques de phases I et II en concentration progressive et essais de toxicologie et de rejets possibles immunitaires sont assez positifs. Ils ont cependant montré qu’il fallait des intensités lumineuses très élevées afin d’obtenir un stimulus conséquent chez les patients. D’où la nécessité de recourir à des lunettes spéciales qu’ont mises au point deux start-up spécialisées. Ces lunettes sont dotées de micro-caméras qui captent les changements d’intensité lumineuse et les retransmettent à l’œil au moyen d’une sorte de vidéoprojecteur, en images virtuelles monochromes, projetées à forte intensité sur les cellules ganglionnaires de la rétine qui peuvent ainsi envoyer un stimulus correct au cerveau.
C’est donc tout récemment en 2021 qu’un patient ayant perdu la vue par la mort des cellules photoréceptrices de la rétine, conséquence d’une rétinopathie pigmentaire, a retrouvé partiellement la vue au cours de cet essai clinique. Cette maladie génétique dégénérative de l’œil se caractérise par une perte progressive de la vision. Les chercheurs pensent aussi que cette approche par protéines photosensibles peut s’appliquer à d’autres pathologies de la rétine dont la dégénérescence maculaire qui se lie à l’âge de plus en plus élevé de nos concitoyens.
Il est remarquable que ce qui avait été annoncé en 2017 par une conférence en guise d’interrogation à la Maison de la chimie : « Faire revoir un aveugle avec le système photosensible d’une algue : bientôt une réalité ? » (2) soit vraiment devenu une réalité, 4 ans après, à partir d’une source naturelle (4) grâce aux biochimistes, ophtalmologues et star-up français et suisses.
Jean-Claude Bernier
Mai 2021
Pour en savoir plus
(1) La rétine en silicium (vidéo Les idées Plein la Tech)
(2) Faire revoir un aveugle avec le système photosensible d’une algue : bientôt une réalité ? conférence et article de Serge Picaud, Colloque La chimie et les sens, 22 février 2017
(3) Zoom sur la valorisation des algues Jean-Pierre Foulon
(4) Nature et chimie : des alliées pour accéder à de nouveaux médicaments conférence et article de Janine Cossy, Colloque Chimie et nouvelles thérapies, 13 novembre 2019
En mai 2021 la commémoration du bicentenaire de la mort de Napoléon 1er a suscité de nombreux articles et livres qui ont parfois créé la polémique sur les qualités et défauts de l’empereur français. Peu ont rappelé combien la science et ses applications avaient été l’objet d’attention particulière de la part du souverain. Car dès sa formation il montre un penchant marqué pour les mathématiques et les sciences physiques qu’il gardera au cours de sa carrière.
Général commandant de la campagne d’Italie il écrit : « Le peuple français ajoute plus de prix à l’acquisition d’un savant mathématicien qu’à celle de la ville la plus riche ou la plus populaire ». Surprenante déclaration d’un général en chef de l’armée d’Italie qui de plus s’est fait accompagner par Monge et Berthollet pour aussi séduire à sa table des savants italiens comme Volta spécialiste des courants électriques et de l’électrochimie (1).
À son retour il veut aussi connaître la communauté scientifique et avec l’aide de ces deux mêmes mathématicien et chimiste se fait élire à l’Institut en décembre 1797. Il s’y comporte comme un membre ordinaire mais suscite un intérêt croissant qu’il s’empresse de communiquer à la nation par les journaux.
C’est ainsi que se bâtit la curieuse expédition d’Égypte qui fait s’embarquer 32000 hommes en mai 1798 à Toulon mais aussi la Commission des sciences et des arts avec plus d’une centaine de scientifiques issus de l’Institut et de l’École polytechnique créés respectivement en 1795 et 1794. C’est encore Monge et Berthollet aidés par Joseph Fourier qui animeront les recherches et explorations jusqu’au retour de Bonaparte et le rapatriement de la Commission en 1803. La rédaction d’un ouvrage monumental se poursuivra jusqu’en 1809 avec une masse incroyable de résultats historiques, géographiques et scientifiques.
Après le 18 brumaire le premier consul crée en 1801 la Société d’encouragement à l’industrie nationale qui rassemble les élites savantes autour de projets industriels. Il confiera ainsi à des scientifiques de hautes fonctions politiques. C’est ainsi que le chimiste Antoine François Fourcroy sera directeur de l’Instruction publique et le chimiste Jean Antoine Chaptal sera ministre de l’Intérieur.
Mais qui sont donc ces chimistes qui doivent en partie à Bonaparte puis à Napoléon leur réussite ?
C’est tout d’abord Claude Louis Berthollet (2), fils de notaire, né à Talloires (duché de Savoie appartenant alors au royaume de Sardaigne), qui effectue des études de médecine à Turin. À Paris il devient médecin du Régent, le duc d’Orléans, qui met à sa disposition son laboratoire du Palais Royal. En 1780 il polémique avec Lavoisier sur le rôle de l’oxygène mais reconnait vite son erreur et publie avec lui la célèbre Méthode de nomenclature chimique en 1787 qui marque les débuts de la chimie moderne. Sa grande découverte en 1789 est le blanchiment des fibres de lin par des solvants chlorés qui donne un grand essor à la culture et au textile du lin en supprimant le long blanchiment (2) sur pré. Il est nommé professeur de chimie à l’École polytechnique et participe avec plusieurs collègues à l’expédition d’Égypte où il se lie d’amitié avec Bonaparte. En 1801 il publie son ouvrage Recherche sur les lois de l’affinité où l’on trouve l’analyse de nombreux corps de compositions jusqu’alors inconnues. Chargé d’honneurs et sénateur comblé il fonde la Société d’Arcueil et le laboratoire où se retrouveront de nombreux chimistes pour y mener de nouvelles expériences jusqu’en 1822.
Antoine François Fourcroy (3) s’est vu confier la chaire de chimie au « Jardin du Roi » en 1784. Fin politicien et bon orateur il siège à la Convention et survivra aux diverses vagues de la Révolution en se chargeant déjà de la réforme de l’instruction publique. Il intègre l’Institut et en sera le président de la section chimie en 1797. Après le 18 brumaire Bonaparte le nomme conseiller d’Etat. Préoccupé par l’état sanitaire déplorable, il crée les écoles de santé et rédigera les textes fondateurs, souvent retravaillés par Napoléon, de l’Université impériale chargée de gérer et contrôler l’ensemble des établissements d’enseignements de l’Empire et créée par décret en 1806.
Louis Nicolas Vauquelin (4) venu d’une famille pauvre normande monte à Paris où il tombe malade et erre dans les rues jusqu’à ce qu’un pharmacien Cheradame le recueille et l’instruit. Celui-ci, émerveillé par son intelligence le présente à un ami de la famille, A.F. Fourcroy. Celui-ci le prend dans son laboratoire et le fait connaître dans le milieu scientifique. Nommé professeur en frimaire an IV, admis à l’Institut il participe à la rédaction des Annales de chimie, puis avec ses collègues chimistes part chercher les tonneaux de salpêtre par toute la France pour fournir des explosifs aux armées de la patrie en danger. Pour obtenir le poste de professeur à la faculté de médecine il passe vite le doctorat en médecine. Par ses travaux il découvre la strychnine avec Pelletier et Caventou et dans ses travaux sur les plantes isole plusieurs acides aminés l’asparagine, des pectines, la nicotine, l’urée urinaire. En chimie minérale il découvre l’élément chrome et un nouvel élément, le glucinium qui sera prendra plus tard le nom de béryllium.
Joseph Louis Gay-Lussac (5), fils d’un juge à Pont-de-Noblat en Haute Vienne. Ce n’est qu’après la mort de Robespierre qu’il vient à Paris où il apprend l’anglais et les mathématiques. Admis à l’École polytechnique en 1797 à 19 ans, il suit les cours de chimie de Fourcroy, Vauquelin, Chaptal et Berthollet. Rien d’étonnant à ce qu’il devienne l’assistant de Berthollet et participe aux travaux sur le traitement des fibres de lin par les composés chlorés (6) dans le laboratoire d’Arcueil. Accueilli à l’Institut en 1806 il devient professeur de chimie à Polytechnique puis au Muséum d’histoire naturelle et à la faculté des sciences de Paris. Ses travaux sur la chimie et la thermodynamique des gaz font autorité comme ses travaux sur le magnétisme qui lui donnent l’occasion de battre des records d’altitude en ballon. C’est avec Thenard qu’il isole le potassium et découvre le bore. Mais il a aussi beaucoup de collaborations avec l’industrie de l’acide sulfurique et du verre puisqu’il présidera le conseil d’administration des glaces de Saint-Gobain (7).
Jean Antoine Chaptal (8). Voilà encore un chimiste qui a débuté par des études de médecine à Montpellier en 1777. Mais, passionné il se rend à Paris pour étudier la chimie. Son oncle l’aide à construire des ateliers où il améliore la production d’acide chlorhydrique. Sa fabrique se diversifie et prend de l’essor, ses produits sont connus dans toute l’Europe. C’est revenu à Montpellier dans la chaire de chimie qu’il se penche sur la formule de Lavoisier de transformation du sucre en alcool. Il publie sa doctrine en 1799 sur la vinification du vin. Son traité sur « la chaptalisation » du vin en 1807 révolutionne l’œnologie (9). À Paris, professeur de chimie végétale à Polytechnique, membre de l’Académie des sciences il poursuit ses activités industrielles et politiques puisqu’en janvier 1801 il est nommé ministre de l’Intérieur et ce sera lui qui élaborera la loi qui institue préfets, sous-préfets et arrondissements. Il démissionnera en 1804 pour être nommé sénateur. Outre ses écrits sur la vinification on lui doit la fabrication artificielle de l’alun, du salpêtre et d’un type de ciment.
Armand Jean François Seguin. Collaborateur de Lavoisier et cobaye humain pour ses essais sur la respiration, très bon expérimentateur, il fit fortune en inventant une méthode rapide de tannage des cuirs à base d’acide sulfurique et de tannins divers. Fournisseur de cuir pour les armées de l’Empire il installa une grande manufacture sur l’île de Sèvres sur la Seine qui traitait plus de 100 000 peaux par an. Sa fortune lui permit d’acheter plusieurs châteaux, mais les affaires périclitant, des spéculations aventureuses l’obligent à vendre une bonne partie de ses immeubles et à transformer sa manufacture en un haras pour chevaux de course. Il réservait ses communications scientifiques sur l’opium ou le quinquina à l’Académie dont il était correspondant. Son île sera industrialisée bien plus tard en 1925 par Renault et s’appellera bien sûr l’île Seguin.
Curieux destins pour ces chimistes qui surent survivre aux changements radicaux de régimes, de la royauté à la Restauration en passant par la Révolution, le Consulat et l’Empire. Au cours de ces changements sociétaux, ils ont cependant jeté les bases de la chimie moderne et initié les débuts d’une industrie nationale. Faut-il y voir le sens de l’investigation, de la patience, de l’observation et du pragmatisme des chimistes, pour surnager aux vagues parfois sanguinaires des révolutionnaires et se glisser dans un ordre nouveau qui fera leur fortune, mais dictatorial ?
Jean-Claude Bernier et Françoise Brénon
Mai 2021
Pour en savoir plus
(1) La pile électrique : tout a commencé avec des grenouilles
(2) Berthollet (1748-1822) et ses œuvres
(3) Antoine François de Fourcroy (1755-1808), promoteur de la loi de germinal an XI
(4) Conférence de M. le Professeur Delépine : les œuvres chimiques de Vauquelin
(5) Louis Joseph Gay-Lussac (1778–1850)
(6) Berthollet, le pharmacien Curaudau et l’identification du chlore
(7) Comment faire des vitrages avec du sable ? La réaction de fusion du verre
(8) Chaptal (1758–1822)
(9) De la vigne au verre : tout un art ?
Deux programmes pour verdir l’Europe
Connaissez-vous le CBE ou Circular Bio-based Europe qui succède depuis février au BBI JU ou Bio-based Industries Joint Undertaking ? Non pas vraiment ? Eh bien ce sont deux programmes européens.
Le premier, créé en 2014, a été basé sur une collaboration public–privé entre la commission et le consortium des bioindustries composé de plus de 100 entreprises dont plusieurs dizaines de la chimie. Sous la forme d’un « Public Private Partnership »il a été doté de 2,7 Mrd€ dont 1 Mrd issu de Bruxelles et 1,7 Mrd venant des industriels.
Son successeur jusqu’en 2027 devrait aussi mobiliser 2 Mrd€. Les réponses aux appels d’offres sont sélectionnées par un groupe mêlant les représentants des États et le comité scientifique. Ces dispositions ont permis de créer onze bioraffineries (1) en Europe dont trois en France, en réduisant les risques des investissements dans ces industries biologiques et en les connectant avec le marché pour créer une bioéconomie durable et compétitive en Europe. Elles sont dénommées « flagships » ou « bioraffineries phares ».
Voyons les résultats pour la France qui prend la première place de ce programme puisque trois projets y sont aboutis.
RESOLUTE – Un biosolvant non toxique à partir des déchets ligno-cellulosiques
C’est un projet mené par la société Circa spécialisée dans la fabrication des solvants organiques biosourcés (2). C’est la production à grande échelle d’un nouveau solvant non toxique à partir de résidus forestiers pour répondre à la demande de l’industrie des pâtes et papiers de valoriser ses déchets et de diversifier ses activités.
Circa avec l’université de York et d’autres partenaires dont AgroParisTech a mis au point depuis plusieurs années un procédé de fabrication de la levoglucosénone (LGO) intermédiaire pour les polymères spéciaux, des parfums et des actifs pharmaceutiques.
Mais le principal débouché commercial est le cyrène obtenu par hydrogénation du LGO (voir figure) solvant aprotique dipolaire et chiral qui va remplacer avantageusement le NMP (N-méthyl-2-pyrrolidone) et le DMF (N,N-dimethylformamide) qui sont sous pression réglementaire à cause de leur toxicité. Après avoir reçu l’approbation de l’ECHA (3) pour son biosolvant et investi plusieurs millions d’euros pour des pilotes produisant 100 tonnes de cyrène par an, une unité industrielle est en cours de construction sur le site chimique de Carling Saint-Avold pour produire environ 1000 tonnes fin 2022.
Suite à des travaux universitaires du CSIC de Madrid, le cyrène s’est révélé avoir les propriétés chimiques et physiques idéales pour l’exfoliation du graphite et les dispersions du graphène. C’est un nouveau débouché high-tech qui s’ouvre alors pour la commercialisation des encres pour l’électronique et les revêtements conducteurs.
AFTERBIOCHEM – Comment fabriquer des acides à partir des pulpes de betterave
C’est un deuxième « flagship » porté par la société Afyren spécialisée dans l’ingénierie en biologie. Elle a investi depuis 2016 dans un procédé qui convertit les déchets agroindustriels de betterave issus de l’industrie sucrière (4) en « building blocks » par fermentation anaérobie, puis dans une deuxième étape à les transformer en acides carboxyliques R-COOH. Grâce au programme européen BBI JU et la contribution de Bpifrance le projet industriel s’implante lui aussi sur la plateforme attractive Chemesis de Saint-Avold qui dispose de services partagés entre les entreprises chimiques du site. C’est un investissement de plus de 60 millions d’euros et la création de 60 emplois qui permettront à Afyren de produire dès 2022 16.000 tonnes d’acides acétique (5), propanoïque, butanoïque (butyrique) et pentanoïque (valérique)… aux applications multiples en agroalimentaire, lubrifiants, cosmétiques, plastifiants et pharmaceutique.
FARMŸING – synthétiser des protéines à partir de déchets organiques
Le troisième « flagship » français est porté par la société Ÿnsect spécialisée dans la production de protéines pour l’alimentation animale (6). C’est sans doute le plus original bien que le terme de bioraffinerie ne soit pas adéquat. C’est probablement la plus grande ferme horizontale d’Europe qui s’implante à Poulainville près d’Amiens. Sa production bien maitrisée par Ynsect et protégée par une trentaine de brevets consiste à « industrialiser » la larve de Tenebrio molitor connue sous la dénomination du ver de farine qui consomme pour grossir toutes sortes de matières organiques, graisses, végétaux, déchets ménagers… et qui est une source de nutriments naturels pour de nombreux animaux, poissons, volailles, porcins, chiens et chats…
Cofinancée par BBI JU, la région Hauts-de-France et divers fonds d’investissement, cette ferme qui va s’élever sur 40 000 m2 et 35 mètres de hauteur sera économe en eau et en énergie et devrait dès 2022 produire 1500 tonnes de protéines par mois. Cette unité, écoresponsable et durable économiquement, peut éviter une pêche supplémentaire de poissons sauvages, l’importation de soja et la diminution d’entrants azotés pour les produits et plantations destinées à l’alimentation animale.
Pour sourire, signalons un autre débouché : déjà plusieurs firmes commercialisent aussi pour l’apéro (7) ces vers Tenebrio molitor cuisinés et à croquer, d’une saveur comté-pointe de muscade rappelant l’amande et la noix de cajou riches en protéines et oméga 3 et 6 ! À votre santé !
Une nécessaire adaptation des bioraffineries au marché concurrentiel
Pour rester sérieux, il est clair que ces « bioraffineries » vont commercialiser des produits à forte valeur ajoutée dont les prix à la tonne vont permettre une rentabilité qui assurera leur durabilité sur le marché.
Cela contraste avec les difficultés que rencontrent les bioraffineries de la Mède ou de Grandpuits d’une part pour assurer un approvisionnement en graisse animale, huile de palme ou de cuisson usagée et d’autre part pour commercialiser des carburants que l’on peut directement incorporer dans le kérosène. En effet, le prix à la tonne, trois à quatre fois celui du kérosène classique, et les récentes fermetures de vols intérieurs vont rendre difficile l’essor commercial sans mesures d’assistance, preuve à l’appui que la bioingénierie en chimie a son créneau dans les produits et intermédiaires chimiques de valeur.
Jean-Claude Bernier
Avril 2021
Pour en savoir plus
(1) Introduction aux bioraffineries et La bioraffinerie de Bazancourt-Pomacle, L'Actualité chimique n° 375-376 (2013) pp. 46-48 et. 49-55
(2) Les solvants biosourcés : opportunités et limitations, P. Marion et F. Jérôme, L’Actualité chimique n° 427-428 (2018) pp. 91-94
(3) L’évaluation des substances chimiques dans le cadre de la mise en œuvre de REACH, conférence et article de C. Gourlay-Francé, Colloque Chimie et expertise - santé et environnement (2015)
(4) Zoom sur le saccharose : de la betterave au sucre, L. Amann, Mediachimie
(5) La chimie du vinaigre, R. Guelin, dossier pédagogique Mediachimie /Nathan
(6) La science et la technologie de l’alimentation vues par la chimie du bouillon, H. This, Colloque La chimie et l’alimentation (2010)
(7) Au menu de nos cousins : diversité, perception gustative et chimie des aliments des primates, S.Krief et Cl.-M. Hladik, Colloque La chimie et l’alimentation (2010)
La chimie n’arrête pas d’innover pour le bien de nos concitoyens en cette période de pandémie où les gestes barrières et le port du masque sont essentiels. Le manque de visibilité des visages apporté par les masques classiques en polyéthylène (1) est sur le point d’être contourné. Le professeur Vandensoep et son équipe de l’institut de Gand–Wevelgem, après plus de 12 mois de recherche, viennent enfin de publier des résultats sur un masque totalement transparent quasi invisible.
Après plusieurs essais sur des masques en polyéthylène multicouches directement issus de l’emballage alimentaire (2) on s’est aperçu que les couches filtraient bien l’oxygène mais pas l’azote et le gaz carbonique rejetés par les voies respiratoires, ce qui a failli entraîner des accidents heureusement sans grande gravité chez les volontaires testés. Ces essais malheureux ont cependant été très instructifs et ont conduit à l’élaboration de plusieurs prototypes.
Le masque est composé d’une mince feuille de polycarbonate percée de milliers de nano-trous et revêtue à l’extérieur d’une couche de polymères possédant une chaine perfluorée qui assure la « déperlance » (3) du masque. Ainsi l’air inspiré et les gaz expirés peuvent circuler mais les micro-gouttes des aérosols extérieurs, véhicules du virus, sont arrêtées et regroupées en macro-gouttes, tout en conservant la transparence du masque. Sa dénomination commerciale se ferait sous la marque Carat.
Le débit d’inspiration et d’expiration doit cependant faire face à une perte de charge due aux dimensions de nano-trous, c’est alors que l’équipe du professeur Vandensoep a eu l’idée de collaborer avec celle du professeur Trugludu de l’Université libre de Roubaix, spécialisée dans l’optique et notamment dans les micro-lasers. Ils ont alors augmenté les diamètres de micro-trous afin de diminuer la perte de charge et placé au-dessus des oreilles des micro-lasers (4) alimentés par des cellules photoélectriques disposées sur un serre-tête du porteur du masque qui balayent la partie avant du masque et font éclater toutes les gouttes des aérosols meurtriers. Sa dénomination commerciale est prévue sous le nom de Carré, compte tenu de sa forme plus anguleuse.
C’est alors, vu la complexité et surtout le coût de ce dernier masque, que l’idée de faire appel à des polymères autoréparables est venue à l’équipe, en utilisant des polymères à liaisons covalentes réversibles associant un réseau de type silicone et un autre réseau supramoléculaire (5). La mince feuille de polycarbonate est alors revêtue de cette couche autocicatrisante. Les trous de cette dernière pouvant être obturée par la simple chaleur de l’air expirée. L’équipe a alors donné à ce prototype le nom de « dArpone d» qui rappelle la base silicone, il demande encore à être testée pour la réversibilité des cycles.
Nul doute que d’ici peu les masques chirurgicaux difficiles à porter seront remplacés par ces masques qui permettront de mieux visualiser les visages et contribuer à la vie sociale. Souhaitons rapidement la fabrication des masques Carat, Carré et Arpone pour le bien-être et la sécurité de nos concitoyens.
Jean-Claude Bernier
1er avril 2021
Pour en savoir plus
(1) Oui la chimie avance masquée
(2) Chimie et maîtrise de la lumière
(3) Les textiles et les vêtements pour le sport
(4) La chimie à la lumière du laser : un intérêt réciproque
(5) Matériaux et chimie supramoléculaire (vidéo)
Les vagues de froid
Février 2021 a vu une météo très changeante et des vagues de froid vif en Europe du Nord et sur le continent américain. Des chutes importantes de température, accompagnées de chutes de neige abondantes, ont sévi en Scandinavie, au Canada et sur la côte Est des États-Unis. Plus surprenant un anticyclone arctique est descendu en Amérique au-delà de la Nouvelle-Angleterre et jusqu’au Texas. Des températures polaires de -19°C à -9°C et même -41°C dans le Minnesota ont été relevées alors même que neige et verglas paralysaient la circulation. Six états US ont déclaré l’état d’urgence grand froid et plus de 3 millions de foyers au Texas ont été privés d’électricité durant plus de 48 h (1) ainsi que d’eau courante pour plusieurs semaines, l’eau ayant gelé dans les canalisations.
En Europe, la Scandinavie a aussi été frappée d’une vague de froid qui a un peu débordé sur la France et le nord-est de l’Allemagne. La vertueuse Suède qui a remplacé ses centrales thermiques et nucléaires par des filières renouvelables (2) a vu tomber leur production électrique de 25% à 9%, les éoliennes étant gelées et les panneaux photovoltaïques enneigés. Pour échapper au black-out elle a remis en route la centrale au fioul et a eu recours à de l’électricité venue d’Allemagne, de Pologne et de Lituanie, las issue de centrales à charbon ! Les Suédois et Suédoises ont été invités par le gouvernement à réduire leur consommation, ce à quoi ils et elles ont répliqué par « #dammsugarupproret », soit « la révolte des aspirateurs ».
Les causes
On peut s’étonner que dans un État aussi riche en sources d’énergie qu’est le Texas, un black-out généralisé puisse arriver. Les hommes politiques ont été très interpellés à la suite de ces incidents qui ont tout de même fait plus d’une dizaine de morts. Certains ont pointé le pourcentage trop élevé de sources d’énergie intermittentes. La société privée de distribution ERCOT a fait l’objet de nombreuses critiques soulignant ses faibles investissements sur les lignes et le grand défaut du manque d’interconnexions avec les sources d’énergies d’autres États et au réseau national (3).
C’est là la grande différence avec l’Europe. Pour la France, une vague de froid fin 1978 avait provoqué une panne d’électricité générale le 19 décembre où les trois quarts du pays avaient été privés de courant durant une dizaine d’heures, alors que commençaient à produire les premières centrales nucléaires et que l’interconnexion des boucles de distribution était encore incomplète.
La leçon à cette date fut bien comprise. Il fut décidé d’accélérer le programme nucléaire et de parfaire une interconnexion européenne qui autorise les échanges de puissance électrique entre pays permettant de pallier des incidents locaux ou des conditions climatiques géographiques particulières. Il y a donc en Europe un marché d’échange du MWh qui, lors de la vague de février, est brutalement monté à 200 € au lieu de 30 €.
Les solutions
Au-delà de la toile d’araignée des interconnexions de grandes lignes de courant, il y a une réflexion sur notre avenir énergétique dans la perspective de la transition écologique. L’intermittent éolien et solaire n’est viable que s’il est soutenu par une source d’énergie constante (4) et modulable facilement suivant la demande et si possible non polluante. À ce sujet connaître la valeur en émission CO2 du KWh est cruciale (voir tableau ci-dessous).
| Filière | nucléaire | hydraulique | gaz | fioul | charbon |
| G CO2/kWh | 6 | 6 | 418 | 730 | 1060 |
Pour les producteurs et régulateurs de réseau c’est un vrai casse-tête car comment ajuster en temps réel demande et production et comment faire face à des conditions extrêmes - froid intense, neige et glace et anticyclone permanent - sans vent durant plusieurs jours (5) ? Les centrales thermiques à gaz ou fioul peuvent répondre assez vite mais comme elles ne fonctionnent que quelques jours par an, leur kWh est cher et peu d‘investisseurs sont enclins à s’y intéresser. De plus leur bilan carbone n’est pas bon. En France l’hydraulique peut répondre assez vite à ces hausses de demande. Pour le nucléaire, actuellement le CEA et EDF planchent sur un procédé de variation rapide de 20% à 80% de la puissance d’un réacteur en moins d’une heure (6). Par ailleurs la recherche et quelques réalisations de SMR (petits réacteurs modulaires) vont permettre de diversifier les applications nucléaires de puissance comprises entre 100 et 300 MW et répondre à ces types de demandes (7). Le projet français « Nuward » vient de bénéficier financièrement du plan de relance. Il regroupe le CEA, EDF, TechnicAtome et Naval Group. Avec deux ilots de 170 MW et une seule salle de commande, il sera le plus compact du marché dans une cuve de 4 m de diamètre et de 13,5 m de hauteur dans un bâtiment semi enterré associé à un système de refroidissement passif (sans pompes) garantissant une sureté et une protection de qualité. Modèle le plus compact issu de notre expérience de la propulsion navale, il pourrait être commercialisé en 2035 avec une chaine de fabrication modulaire et standardisée permettant des coûts réduits. Il ne faut pas tarder, car selon l’OCDE/AEN le marché des SMR à cet horizon peut être de 20 GW. Déjà la Russie a installé un SMR sur barge flottante en Sibérie et aux États-Unis la société NuScale prévoit d’installer un premier module en Utah en 2023.
Sur le papier nos gouvernants et l’opinion publique pensent qu’il est simple d’élaborer une transformation énergétique radicale de la société, sur le terrain c’est une autre affaire… (8)
Jean-Claude Bernier
Mars 2021
Pour en savoir plus :
(1) Noël aux tisons ? editorial Jean-Claude Bernier
(2) Une électricité 100% renouvelable : rêve ou réalité ? fiche Chimie et… en fiches
(3) Réseaux de transport de l’électricité et transition énergétique, article et conférence de S. Henry (colloque Chimie et enjeux énergétiques, 2012)
(4) Le challenge de l’électricité verte, collection Chimie et Junior
(5) La complexité du réseau et l’électricité verte, article et conférence de Y. Bréchet (colloque Chimie et enjeux climatiques, 2015)
(6) Équipe de recherche (vidéo du CEA)
(7) Le nucléaire de fission dans le futur. Complémentarité avec les renouvelables, conférence de C. Behar (colloque Chimie et énergies nouvelles, 2021)
(8) Vitesse de déploiement et acceptabilité des nouvelles technologies dans le domaine des énergies, conférence de G. de Temmerman (colloque Chimie et énergies nouvelles, 2021)
Image d'illustration : K. et B. Emerson - Flickr
licence Creative Commons Attribution 2.0 Générique.
Ce début février est marqué par le retour de températures hivernales classiques et négatives. C’est alors une floraison dans tous les journaux papiers ou télévisés d’une série de reportages et conseils plus ou moins pertinents liés à ces basses températures. Pourquoi Mediachimie ne s’y mettrait pas avant que le mercure ne remonte !
Chez vous
Pour un bon cocooning, vérifiez bien que l’isolation de votre maison est bonne. C’est d’abord 15 à 20 cm de laine de verre ou de cellulose dans vos combles qui vous font économiser 30% sur la fuite des calories (1). Les vitrages à haute isolation de vos baies vitrées et fenêtres avec deux lames de verre sodo-calciques séparées par un volume d’argon et disposant sur l’une des faces intérieures d’un micro-revêtement métallique renvoient les infrarouges vers l’intérieur et évitent de chauffer le jardin (2). Si vous avez un chauffage électrique vos murs sont équipés de contrecloisons en plâtre munies d’une bonne épaisseur de polystyrène. Pensez aux radiateurs à accumulateurs de chaleur qui, équipés d’une âme de céramique (silico-aluminates de calcium) chauffée la nuit, restituent ses calories le jour. Grâce à la chimie des matériaux vous économisez les kWh tarif nuit.
En voiture
Attention, au démarrage n’oubliez pas que votre bonne vieille batterie au plomb perd 33 % de sa puissance lorsqu’on atteint –5°C (3). Si vous roulez au diesel vérifiez bien que vous avez fait le plein à la pompe avec le gas-oil hiver qui a un point de cristallisation à –15°C et qu’il ne vous reste plus du gas-oil été (qui cristallise à 0°C), bien que pour des raisons commerciales il semble que certaines marques fournissent un carburant unique été – hiver. Si vous roulez à l’éthanol (E 85) le démarrage à froid est parfois plus difficile car les vapeurs d’alcool sont moins inflammables. Les pétroliers diminuent en hiver la proportion d’éthanol qui peut descendre à 60% eu lieu de 85% en été (4).
Assurez-vous que le liquide de refroidissement (souvent appelé antigel) de votre moteur est bien adapté à l’hiver afin qu’il ne gèle pas dans votre réservoir. Mélanges d’eau, d’éthylène glycol ou de propylène glycol et d’additifs, ils peuvent supporter sans geler des températures pouvant descendre à –25°C ou moins selon les proportions (5).
Si la route est glissante à cause du verglas, heureusement les municipalités et la DDE ont salé les revêtements (6). Mais roulez avec des pneus hiver qui ont une gomme tendre à base de caoutchouc naturel et de mélanges butadiène / acrylonitrile. En effet suivant la composition la température de transition vitreuse est abaissée et par temps froid le pneu reste souple procurant une meilleure tenue de route (7).
Si le matin vous déneigez carrosserie et pare-brise, utilisez une raclette en polystyrène ou polypropylène moins dure que le verre ou le vernis de peinture pour ne pas faire de rayures. Pour la couche de glace sur le pare-brise, une « pulvérisette » d’alcool ménager vaut mieux que l’eau chaude car le mélange eau – alcool se solidifie à bien plus basse température que 0°C. Enfin si les montants de portes ont leurs joints caoutchouc collés, pensez à les enduire d’une fine couche d’éthylène glycol qui tiendra jusque –45°.
À pied dehors
En promenade ou pour faire vos courses n’hésitez pas à vous couvrir en multicouches (8) :
- des sous-vêtements en microfibres très légers, des maillots en fibres creuses qui vont emprisonner de l’air qui est un isolant thermique efficace pour protéger du froid ;
- un « pull polaire » en fibres polyesters aérées qui viennent en partie du recyclage des bouteilles plastiques en PET ;
- une veste en textile imper respirant, imperméable à la pluie ou la neige mais laissant passer la transpiration, obtenu après enduction de polyuréthane ou des membranes hydrophobes comme les polyfluorothylène (9) ;
- ou mieux encore des textiles thermorégulants à changement de phase où sont encapsulées sur les fibres des cires qui se liquéfient à plus de 37°C lorsque vous êtes dans une pièce chauffée et qui, quand vous sortez à l’extérieur au froid, se solidifient en libérant de la chaleur.
On trouve aussi des vêtements et gants pour motards ou artisans du BTP avec des microcircuits de résistances alimentées par des piles ion-lithium qui sur commande peuvent chauffer soit les mains, soit le dos.
En cette période de COVID, vous sortez avec les masques sanitaires en polypropylène qui comportent une couche de « meltblown », microfibres qui par attraction électrostatique captent les nano-gouttes des aérosols pouvant véhiculer le virus (10). Si les masques sont humides les fibres ne servent plus de barrière, donc éviter de les mouiller par la respiration en hiver ou sous la pluie ou la neige. L’Académie de médecine canadienne recommande par grand froid de porter au-dessus une écharpe.
Mais que cela ne vous empêche pas de soigner votre visage et votre peau : par grand froid sec, elle souffre, alors n’oubliez pas les crèmes hydratantes et les rouges à lèvres protecteurs (11).
Parés pour le grand Nord ?
Jean-Claude Bernier
Février 2021
Pour en savoir plus
(1) Isolation dans l’habitat : la chimie pour ne pas gaspiller de calories !
(2) Les vitrages : laissez entre la lumière
(3) Applications présentes et futures des batteries
(4) Pourquoi met-on de l’alcool dans l’essence ? (Question du mois)
(5) Glycol / Éthane-1,2-diol / Éthylène glycol (Produit du Jour Société Chimique de France)
(6) Pourquoi met-on du sel sur les routes lorsqu’il gèle ? (Question du mois)
(7) Le pneumatique : innovation et haute technologie pour faire progresser la mobilité
(8) Vers des textiles intelligents pour des vêtements performants et innovants
(9) Les textiles imper-respirants
(10) Oui la chimie avance masquée
(11) La peau au quotidien : protection et embellissement
Hum ! Un beau gâteau bien gonflé ! Les recettes des cakes, quatre-quarts, madeleines, cookies… nécessitent de la levure dite « chimique ». De quoi s’agit-il et à quoi sert-elle ?
Tout d’abord le mot « levure chimique » est utilisé pour se différencier de la « levure de boulanger » dont l’action est due à des microorganismes.
Pourquoi ajouter de la levure chimique ?
L’objectif de la levure chimique est de libérer un gaz lors de la cuisson afin de faire gonfler la pâte du gâteau. C’est ainsi que ces sachets sont aussi surnommés « poudre à lever » ou « poudre levante ». Dans la pratique ce gaz est le dioxyde de carbone (ou gaz carbonique), CO2. Il est obtenu par une réaction acidobasique une fois que la levure est mélangée aux ingrédients et humidifiée.
Que contiennent les sachets de levure chimique ?
Citons quelques compositions indiquées. Vous reconnaitrez sans doute celle que vous avez achetée :
- diphosphate disodique, carbonate acide de sodium, amidon de blé ;
- pyrophosphate disodique, bicarbonate de sodium, amidon de blé ;
- diphosphate disodique, bicarbonate de soude, amidon de maïs ;
- diphosphtates et carbonates de sodium, farine de blé ;
- pyrophosphate de sodium, bicarbonate de sodium, farine de froment (ancienne formule) ;
- acide tartrique, bicarbonate de soude, fécule de maïs (ancienne formule) ;
- crème de tartre, carbonate acide de sodium, fécule (ancienne formule).
À première vue ces compositions semblent différentes. Regardons de plus près.
Le bicarbonate de sodium, le carbonate acide de sodium et le bicarbonate de soude sont en réalité le même composé chimique dont le nom précis est l’hydrogénocarbonate de sodium et qui a pour formule chimique NaHCO3 (ou Na+, HCO3-) (i). C’est l’ingrédient commun indispensable. C’est lui qui permettra de libérer le dioxyde de carbone en jouant un rôle de base.
Les termes diphosphate disodique et pyrophosphate disodique concernent le même composé de formule Na2H2P2O7 (ii). L’acide tartrique a pour formule C4H6O6 (iii) et la crème de tartre KC4H5O6. Ce sont tous les trois des composés au comportement acide en présence d’eau.
La farine de froment, l’amidon de blé ou la fécule ou l’amidon de maïs contiennent tous de l’amidon [1]. Il est nécessaire à la conservation ou stabilisation du produit avant usage en limitant la réaction chimique entre les deux autres constituants et en absorbant l’humidité. Il est donc très important que le sachet soit conservé au sec.
Lors de la réalisation de la recette, il est aussi nécessaire de mélanger à sec la levure à la farine avant l’ajout des ingrédients humides.
L’ajout d’eau
Quelle que soit la recette, l’ajout d’eau est indispensable. Elle est apportée soit avec les œufs (l’eau représente 75% de la masse d’un œuf), soit avec un jus de fruit, du lait, ou tout simplement de l’eau seule…) . Elle dissout les acides et les bases contenus dans la levure, facilite le malaxage des ingrédients et la mise en contact des réactifs.
Le gonflement : quelles réactions ?
Une réaction entre acide et base
Une fois tous les ingrédients de la recette bien mélangés, les acides présents échangent un proton H+ avec le bicarbonate selon, par exemple :
H2P2O72- + HCO3- → CO2 (gaz) + H2O + HP2O73-
Cette réaction commence faiblement dès le mélange à froid puis à la chaleur du four, le dégagement de CO2 s’accentue et s’accélère.
En effet cette réaction est équilibrée avec une constante d’équilibre proche de 1. Le chauffage est favorable au dégazage de CO2 ce qui déplace l'équilibre jusqu’à la consommation totale du bicarbonate. Ainsi la pâte lève ; il se crée des alvéoles. Puis la pâte alvéolée se solidifie en gardant sa forme. Voilà c’est réussi !
Le composé secondaire formé HP2O73- est à la fois un acide et une base et seul dilué donnerait un pH voisin 7,3, soit un pH quasiment neutre. S’il reste du réactif initial H2P2O72- le pH serait alors légèrement inférieur à 7.
Pourrait-on utiliser du bicarbonate seul ?
C’est envisageable car il participe à l’équilibre 2 HCO3- = CO2 (gaz) + CO32- + H2O qui montre une formation possible de dioxyde de carbone et de carbonate. Toutefois le dégagement est quasi nul à froid, l’équilibre étant en faveur de HCO3- et ne se fait que lentement et de façon moindre à partir de 70 °C.
Le gâteau peut se solidifier avant que la pâte soit totalement levée. De plus l’ion carbonate CO32- formé en parallèle donne un milieu très basique au goût peu agréable.
Et le jus de citron ?
Quand l’eau est ajoutée sous forme de jus de citron (cake au citron, par exemple) cela introduit de l’acide citrique (iv) qui participe notablement à l’augmentation du dégazage. Il n’est en général pas totalement consommé ce qui donne ce petit goût acide caractéristique de cette pâtisserie. Mais ce n’est pas son seul rôle : il influence le caractère viscoélastique de la pâte à base de farine.
Que faire si on est en panne de levure chimique ?
Vous pouvez utiliser du bicarbonate de sodium et ajouter un peu de jus de citron.
Effervescence et analogie
On peut noter que toutes sortes de produits effervescents (dont des médicaments) présentent les mélanges bicarbonate et acide citrique ou bicarbonate et dihydrogénophosphate donnant du CO2 dès l’ajout d’eau.
Historiquement
Aux États Unis, c’est dans les années 1840 qu’apparait dans un livre de cuisine la proposition d’ajouter aux ingrédients d’une pâte de gâteau du bicarbonate de sodium et de la crème de tartre. Puis de nombreux essais ont été réalisés, y compris en Europe, pour sélectionner l’acide à ajouter avec le bicarbonate, la source d’amidon et les bonnes proportions. Les industriels ont alors vendu des mélanges prêts à l’emploi, aux proportions jalousement gardées.
Et le bicarbonate de sodium, matière première indispensable
Composé connu depuis l’Antiquité à l’état naturel, c’est le Français N. Leblanc qui a mis au point le premier procédé de fabrication à la fin du XVIIIe siècle [2], plus tard supplanté par le procédé Solvay [3]. Le premier producteur mondial est encore Solvay. Il existe des gisements naturels conséquents de bicarbonate aux États-Unis.
Le bicarbonate a de très nombreuses autres applications [3] [4].
Allez, à vos recettes !
Et n’oubliez pas de bien respecter les proportions. Les sachets vendus contiennent en général 10 g de levure à mélanger dans 500 g de farine. Un défaut de levure et le gâteau n’est pas levé, un excès de levure et le gâteau ne lèvera pas plus mais aura au final un arrière-gout de levure.
Françoise Brénon
(i) Cet additif alimentaire a pour code E500. Il est appelé baking soda dans les recettes américaines. Dans une des compositions lues sur les sachets, le terme « carbonates » avec un s (donc pluriel) est imprécis et fait penser à un mélange de carbonate ( CO32-) et d’hydrogénocarbonate. Ces composés appartiennent aux couples acides-bases CO2, H2O / HCO3- / CO32- dont les pKa sont 6,35 et 10,3 et jouent un rôle similaire.
(ii) Il s’agit du dihydrogénopyrophosphate disodique, codé E450i.
Le nom pyrophosphate de sodium indiqué sur un des sachets est imprécis. On pourrait penser à Na4P2O7 dont le nom précis est pyrophosphate tétrasodique. Mais celui-ci est une base ne pouvant donc réagir avec le bicarbonate pour donner du CO2. En réalité à l’analyse le produit contient aussi le E450i, soit H2P2O72-, comme dans les autres sachets. Les couples acidobasiques relatifs à l’acide pyrophosphorique sont : H4P2O7 / H2P2O7- / H2P2O72- / HP2O73- / P2O74- et les pKa correspondants sont 1,0; 2,5 ; 6,1 ; 8,5 (source « Les Réactions chimiques en solution », G. Charlot, chez Masson)
(iii) Ce diacide de formule semi-développée HOOC-CHOH-CHOH-COOH a pour nom précis l’acide 2,3-dihydroxybutanedioïque dont les pKa sont 3,0 et 4,4. Son code est le E334.
KC4H5O6 correspond au monoacide K+, -OOC-CHOH-CHOH-COOH.
Attention le mot courant « tartre » qui correspond au calcaire (CaCO3) qui se dépose sur les canalisations ou les bouilloires n’a aucun lien avec l’acide tartrique. Le nom « crème de tartre » provient des dépôts de tartrate sur les cuves en fin de processus de vinification.
(iv) L’acide citrique de formule HOOC-CH2-C(OH)COOH-CH2-COOH est un triacide de pKa 3,0 ; 4,4 ; et 5,7. Sa 1ère acidité est plus forte que celle de H2P2O72- et sa réaction sur HCO3- est totale.
Pour en savoir plus
[1] Zoom sur l’amidon sur le Site Mediachimie
[2] Bicarbonate de sodium - produit du jour (sur le site de la Société Chimique de France)
[3] Hydrogénocarbonate de sodium sur le site L’Élémentarium : propriétés, fabrication industrielle, applications
[4] le bicarbonate Solvay® (PDF) sur le site de Solvay