Outre les illustrations et schémas de livres, revues et publicités, les musées et les institutions académiques conservent des dispositifs et des instruments historiques. Ils témoignent de l’inventivité d’une époque, du vieillissement et du remplacement de ces dispositifs et instruments sous l’effet de la disponibilité et du coût. De nouveaux matériaux, de nouveaux produits sans emploi engendrés par d’autres industries et d’autres sources d’énergie sont venus enrichir les moyens techniques de la chimie. Bien qu’ayant progressé ensemble, les avancées des techniques chimiques ont une certaine autonomie vis-à-vis de la science, les techniques ne sont pas que de la science appliquée.
L’eau acheminée aux soldats du front était le lieu de prolifération de nombreux micro-organismes pathogènes sources de dysenteries et de la typhoïde. Et après les premières attaques aux gaz, l’état-major interdit formellement de boire l’eau qui se trouve sur le front car les gaz empoisonnent les eaux stagnantes.
Comment éliminer les micro-organismes pathogènes présents dans l’eau ?
Les méthodes ont évolué vers plus d’efficacité tout au long du conflit et diffèrent selon que l’on dispose d’eau en containers ou d’eau apportée directement et continûment par canalisation.
Pour l’eau fournie en containers le traitement se fait à l’iode avec 3 comprimés : 1 bleu, 1 blanc et 1 rouge. Patriote jusque dans le traitement de l’eau !
C’est en juillet 1902 que le pharmacien Auguste Georges et le médecin Villard [1] [2] décrivent une méthode d’épuration des eaux de boisson dans la revue de médecine et de pharmacie militaire. Les soldats disposent de 3 comprimés (i) :
- Un comprimé bleu contenait de l’iodure et de l’iodate de potassium ainsi que du bleu de méthylène
- Un comprimé blanc contenait du thiosulfate de sodium (ancien nom « hyposulfite de soude »)
- Un comprimé rouge contenait de l’acide tannique
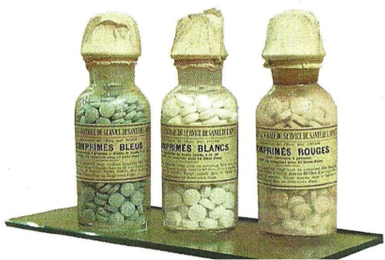

Comprimés tricolores (Musée du Service de Santé des Armées au Val-de-Grâce) source [2] ;
Tonnelet eau, Comprimés blancs et mode d'emploi (Photos F. Brénon au musée du Service de Santé des Armées au Val-de-Grâce)
Le mode d’emploi était le suivant : « Dissoudre 1 comprimé rouge avec 1 comprimé bleu dans ½ verre d’eau. Verser le liquide obtenu dans 10 L d’eau à traiter. Agiter. Attendre 10 min. Dissoudre 1 comprimé blanc dans un ½ verre d’eau. Verser cette solution dans les 10 L d’eau traités ».
Le comprimé bleu et le rouge dans l’eau engendraient du diiode, bactéricide et virulicide. Après avoir laissé agir, le comprimé blanc éliminait l’excès de diiode.
Plus en détail, les réactions mises en jeu et l’épuration étaient basées sur le principe suivant : le mélange d’iodure (I-) et d’iodate (IO3-) en présence d’acide (ici l’acide tannique) conduit à former du diiode (I2) dans le 1er récipient, selon la réaction :
IO3- + 5 I- + 6 H+ → 3 I2 + 3 H2O
Les proportions permettent de former une grande quantité de diiode.
L’agitation et le temps d’attente ont pour objet de faire réagir le diiode sur les microorganismes à éliminer.
Une fois l’action « d’épuration » par le diiode terminée, il faut éliminer l’excès de diiode restant. C’est le rôle du comprimé blanc qui permet de réaliser la réaction :
I2 + 2 S2O32- → S4O62- + 2 I-
Cette eau avait toutefois un gout iodé peu agréable.
Notons que le bleu de méthylène est à la fois un colorant et un bactéricide, l’acide tannique est un polyphénol de formule brute C76H52O46 et a aussi des propriétés astringentes et anti-diarrhéiques.
Traitement par les ions hypochlorite
Les ions hypochlorite ClO- sont disponibles :
- soit sous forme de comprimés d’hypochlorite de calcium [Ca(ClO)2], stables et faciles d’emploi pour des usages ponctuels
- soit présents dans l’eau de Javel, solution aqueuse basique de chlorure et d’hypochlorite de sodium, moins stable et plus délicate à utiliser.
L’eau de Javel tire son nom du village de Javel à l’ouest de Paris où elle a été fabriquée de 1784 à 1889. Elle a été utilisée d’abord pour ses propriétés de blanchiment du linge découvertes par Claude-Louis Berthollet (1748-1822) et puis pour ses propriétés désinfectantes en solution diluée étudiées tout particulièrement par Antoine-Germain Labarraque (1777-1850). L’eau de Javel est efficace pour lutter contre la propagation des maladies telles que la typhoïde et le choléra propagées par de l’eau contaminée.
On a montré depuis que l’eau de Javel est à la fois bactéricide et virulicide, propriétés dues aux ions hypochlorite et l’acide hypochloreux [3] [4].
À partir de 1915 le médecin Vincent et le pharmacien C. Gaillard [2] mettent au point une formule de comprimés d’hypochlorite de calcium et de sodium pour purifier l’eau de boisson.
En 1916, le service de santé décide de la javellisation de l’eau, traitement antimicrobien utilisant de l’eau de Javel. Deux méthodes sont possibles :
- LA JAVELLISATION : la quantité d’eau de Javel à ajouter est fonction de la contamination. Les doses sont de 1 à 5 mg de chlore actif (ii) par litre. Si l’eau était alors dépourvue de microorganismes pathogènes, son goût fort en chlore la rendait très désagréable à boire.
- LA VERDUNISATION [3] [4] [5] : le terme « verdunisation » provient de la Première Guerre mondiale au cours de laquelle cette technique a été utilisée à grande échelle pour désinfecter l’eau consommée par les « Poilus » de Verdun.
En effet, lors de la bataille de Verdun, l'Armée française, encerclée, ne disposait plus d'eau potable. Le commandant du Génie Philippe Buneau-Varilla (iii), en 1916 à Verdun, réussit à capter et à acheminer l'eau de la Meuse au moyen de puits, de pompes et de tuyaux jusqu’aux tranchées. Il mit au point un procédé automatique de potabilisation de cette eau en faisant injecter de l’eau de javel diluée juste à l'entrée des pompes centrifuges. Ce procédé préconise des doses d’eau de Javel de dix à cinquante fois plus faibles que la javellisation (de l’ordre de 0,1 mg de chlore actif par litre). Cette eau avait un bien meilleur goût que celle ayant subi une javellisation.
La différence dans l’efficacité vient du protocole : dans ce procédé, l’addition de l’eau de Javel est réalisée lentement avec un brassage vigoureux et prolongé. Ces conditions favorisent la dissolution du dioxyde de carbone contenu dans l’air, ce qui abaisse le pH et favorise le passage de l’ion hypochlorite à la forme acide hypochloreux, HClO, qui est plus bactéricide (iv) [3].
Notes
(i) La composition des comprimés et le mode d’emploi sont indiqués sur les étiquettes des flacons présentées au musée du Service de santé des armées du Val de Grâce (Paris). Les réactions chimiques proposées par F. Brénon en découlent.
(ii) Que signifie l’expression eau de Javel ou chlorure de chaux « à Y grammes en chlore actif » ? L’eau de Javel comme le chlorure de chaux contiennent des ions chlorure, Cl-, et hypochlorite, ClO-, en mélange équimolaire. L’ajout d’un acide fait passer ClO- à l’état d’acide hypochloreux HClO. Et si le milieu devient très acide la réaction de HClO sur les ions Cl- provoque un dégagement de dichlore Cl2 selon la réaction :
(iii) Philippe Buneau-Varilla (1859–1940) était ingénieur polytechnicien. Le procédé de verdunisation qu’il a mis au point en 1916 a été utilisé par la suite dans une cinquantaine d’établissements publics industriels ou miniers et dans plus d’une centaine de villes.
(iv) Ph. Buneau-Varilla a également proposé une action des UV dans la purification de l’eau [6].
Bibliographie
[1] L’épuration de l’eau potable en campagne - Archives de médecine et de pharmacie militaire (juillet 1902) p. 30 à 33 – BnF Gallica
[2] Histoire des comprimés pharmaceutiques en France, des origines au début du XXème siècle, André Frogerais (2013) p. 17 à 20. HAL : hal-00787009v4
[3] L'eau de Javel : sa chimie et son action biochimique, G. Durliat, J.L. Vignes et J.N. Joffin, BUP n° 792 (1997) p. 451 à 469 et tout particulièrement page 464 où est expliqué le rôle du pH et le pouvoir bactéricide de l’acide hypochloreux.
[4] Site internet de la FAO sur les rôles des composés chlorés et iodés : L’hygiène dans l’industrie agroalimentaire . Dans cette ressource il faut toutefois corriger la réaction.
L'hypochlorite de sodium s'obtient suivant la réaction théorique suivante :2 NaOH + 2 Cl → NaOCl + NaCl + H2O
par 2 NaOH + Cl2 →NaOCl + NaCl + H2O
[5] Ph. Bunau-Varilla, Guide pratique et théorique de la Verdunisation, Paris, J-B. Baillière (1930)
[6] Quelques documents sur la verdunisation des eaux , Ph. Buneau-Varilla, p. 40. BnF Gallica
[7] Bunau-Varilla et-la-verdunisation, article de La dépêche (1926)
Crédits illustrations
- Comprimés tricolores (Musée du Service de Santé des Armées au Val-de-Grâce) source [2] ;
- Tonnelet eau, Comprimés blancs et mode d'emploi (Photos F. Brénon au musée du Service de Santé des Armées au Val-de-Grâce)
- Couverture du livre Quelques documents sur la verdunisation des eaux, Ph. Buneau-Varilla, bibliothèque Exército Portugal
Petrus Jacobus Kipp (1808-1864) était né à Utrecht où il avait étudié la pharmacie. En 1830 il s’était installé à Delft comme pharmacien et marchand de produits chimiques et d’instruments de laboratoire. Le commerce d’appareils de laboratoire était ancien à Delft, celui des frères Bayens occupait 14 ouvriers vers 1820. En 1850 Kipp proposait un catalogue de 734 articles.
Il avait inventé un appareil en verre pour produire de petites quantités de gaz avec la possibilité d’interrompre la production à son gré. On l’utilisait dans les établissements d’enseignement du 20e siècle pendant les séances de manipulation que nous appelions familièrement « pêche aux ions ». Il s’agissait de reconnaître la nature des cations dans une solution aqueuse saline. L’appareil est composé de deux parties : une base de deux sphères superposées communicantes munies chacune d’un orifice latéral, et une ampoule qui pénètre dans les deux sphères en s’introduisant par le haut. Dans l’orifice latéral de la partie basse de l’appareil on introduisait du sulfure de fer (pyrite) et on rebouchait l’orifice, l’ampoule contenait une solution d’acide (chlorhydrique ou sulfurique) qui pouvait s’écouler sur la pyrite. Leur réaction produisait du sulfure d’hydrogène gazeux qui se répandait dans la partie sphérique et qui pouvait s’échapper par l’orifice latéral ouvert de la sphère supérieure. Celui-ci était muni d’un tube à dégagement qu’on fermait ou ouvrait à volonté. Par ce tube on envoyait le gaz barbotter dans la solution à analyser.
Quand la solution ne contenait qu’un sel dessous, et si l’addition d’acide chlorhydrique ne donnait pas de précipité, [signalant la présence de plomb, argent, ou mercure (I)], on faisait barboter H2S dans la solution légèrement acidifiée et chauffée vers 70 °C. H2S précipitait certains cations sous forme de sulfures. On filtrait, on lavait le précipité et on en mettait un peu dans un tube avec une solution de sulfure d’ammonium. S’il se solubilisait on identifiait le cation présent dans la liqueur primitive par la couleur de son sulfure, rouge orange pour l’antimoine, jaune serin (et soluble dans l’ammoniaque) pour l’arsenic, jaune sale (et insoluble dans l’ammoniaque) pour l’étain (IV), chocolat pour l’étain (II), brun noir pour l’or. Si le précipité de sulfure était insoluble dans la solution de sulfure d’ammonium et s’il était jaune et soluble dans l’acide nitrique, c’était du cadmium. S’il était noir, ce pouvait être du cuivre, du bismuth ou du mercure (II). La couleur du précipité donné par la liqueur primitive additionnée de potasse permettait de distinguer le cuivre (bleue), du bismuth (blanc), et du mercure (II) (jaune).
À cause de l’odeur nauséabonde et de la toxicité de l’hydrogène sulfuré, l’appareil était maintenu sous la hotte.
L’appareil de Kipp est une page de l’instrumentation pour la chimie minérale. On procède aujourd’hui avec une sensibilité incomparablement meilleure par des méthodes physiques quantitative (spectroscopie d’absorption atomique) pour analyser des produits minéraux.
Dans un autre usage le dispositif permet de fabriquer des gaz : le dispositif pouvait servir à produire du dioxyde de carbone en utilisant du marbre au lieu de pyrite, et du dihydrogène en utilisant du fer.


Orgue de pharmacien chimiste
Pour en savoir plus
Le pharmacien P.-J. Kipp (1808-1864) et son appareil, H.-A.-M. Snelders, Revue d’histoire de la pharmacie 212 (1972) pp. 3-12
Crédits illustrations :
- Appareil de Kipp. MNHN, photo : B. Bodo ; planche Encyclopédie Chimique, E. Fremy (1882)
- Orgue de pharmacien-chimiste, WIkimedia Commons, licence CC0
Voilà 100 ans, le 11 janvier 1922, que pour la première fois un enfant de 14 ans en coma diabétique reçut une injection d’un extrait de pancréas (et donc d’insuline) ; il fut sauvé et survécu 13 ans avec des injections régulières d’insuline.
Quel est le rôle de l’insuline ?
L’insuline est une hormone (i), secrétée par le pancréas, dès que la glycémie (taux de glucose dans le sang) dépasse un seuil. Cette sécrétion favorise un retour de la glycémie à une valeur de base. Son absence ou sa sécrétion insuffisante est responsable des divers types de diabète.
Quelle est la structure de l’insuline ?
L’insuline est une protéine. Sa structure a été décrite en 1955 par Frederick Sanger (ii) et représentée en 3 D par Dorothy Hodgkin (iii) en 1969.
De formule brute C257H383N65O77S6, sa masse molaire vaut 5807 g.mol-1. La structure de l’insuline est complexe. Un premier brin appelé chaine A contient 21 acides aminés (acides aminés notés aa par la suite). Un deuxième brin appelé chaine B contient 30 aa. Ces 2 chaines sont reliées entre elles par 2 ponts disulfures (S-S) entre 2 cystéines de A et 2 cystéines de B. Il existe aussi un pont S-S interne entre deux cystéines de la chaine A. L’ensemble des 2 chaines forme un monomère. Voir image ci-dessous.

Trois dimères se forment grâce à des liaisons hydrogènes entre des aa des chaines terminales de B et sont assemblés entre eux via des interactions avec deux ions Zn(II). L’insuline a donc une structure hexamère.
Insuline humaine et animale
La structure de l’insuline est particulière à l’espèce, mais celles de l’homme, du porc et du bœuf sont très voisines.
L’insuline humaine est différente de l’insuline porcine juste par un aa de la chaine B en position 30. Celle du bœuf diffère en plus par 2 aa de la chaine A en positions 8 et 10.
Les premières insulines administrées aux diabétiques insulino-dépendants
Elles sont extraites de pancréas de bœuf ou de porc, mise en solution acide (pH = 3) et malheureusement imparfaitement purifiées. Le patient doit avoir 3 ou 4 injections par jour. Les impuretés et la différence structurelle de ces insulines sont responsables de réactions locales ou d’allergies. Ainsi, de 1922 jusqu’en 1999 (en France) les diabétiques ont pu recevoir des insulines extraites du porc et du bœuf. Depuis les années 80, les insulines reçues par les diabétiques ont beaucoup évolué.
L’insuline porcine modifiée appelée insuline semi-synthétique humaine
Au début des années 80, l’insuline porcine a subi des transformations enzymatiques permettant de remplacer l’aa alanine en position 30 de la chaine B par l’aa thréonine ; ainsi on obtient une insuline semi-synthétique humaine. Bien qu’apportant au malade une plus grande efficacité, ce procédé nécessitait encore un approvisionnement en insuline porcine et provoquait dans certains cas des réactions de rejet.
Des insulines différenciées pour améliorer rapidité et durée d’action
La notion d’insuline différenciée est liée à la vitesse et la durée d’action. On parle d’insulines, rapides, intermédiaires ou lentes.
Ainsi des insulines rapides sous forme d’hexamères sont injectées pour éviter une augmentation de la glycémie trop importante au moment des repas, tandis que des insulines intermédiaires permettant de combler les besoins humains en insuline indépendamment des repas, sont injectées 2 à 3 fois par jour.
Ces insulines intermédiaires, nommées NPH (Neutral Protamine Hagerdorn), proposées dès 1923 par Hagerdorn, contiennent en plus de l’insuline humaine, des protamines (iv), une quantité variable d’ions Zn2+ et un milieu neutre grâce à un tampon phosphate. Cette formulation injectée diffuse alors lentement dans le corps humain.
L’inconvénient de ces premières insulines différenciées était leur délai d’action et la durée.
L’insuline humaine obtenue par le génie génétique appelée insuline biogénétique humaine ou recombinante
Dès le début des années 80 des insulines humaines obtenues par génie génétique sont apparues sur le marché et depuis 1999 (en France) seules ces insulines sont utilisées.
Très schématiquement, un gène (portion d’ADN) codant pour l’insuline humaine est inséré dans l’ADN d’une cellule hôte, la bactérie Escherichia coli. Celle-ci produit alors de l'insuline humaine grâce au gène supplémentaire intégré. Pour la production de grandes quantités, cette bactérie modifiée est introduite dans un fermenteur où elle se multiplie et produit le composé recherché. Des étapes de séparation et purification sont indispensables.
Pour concrétiser on peut citer pour exemples, deux modes de fabrication industrielle d’insuline recombinante. Ce ne sont pas les seuls.
Dans le premier, il est d’abord créé indépendamment, par génie génétique, les 2 chaines A et B rallongées volontairement par quelques aa dont la présence facilite l’étape chimique ultérieure. À l’issue de ces fermentations ces chaines sont séparées par ultrafiltration ou centrifugation. La création des ponts sulfure (S-S) entre les 2 chaines est alors réalisée par voie chimique. Une chromatographie préparative à basse pression par échanges d’ions est alors réalisée. Une nouvelle étape de réaction chimique ou enzymatique permettant la découpe des aa excédentaires est suivie d’une ultrafiltration puis d’une chromatographie préparative à haute pression (70 bars) sur gel de silice greffé ou non, pour conduire à l’insuline humaine recombinante purifiée à usage pharmaceutique.
Dans le deuxième mode, la bactérie est programmée pour reproduire au cours de la fermentation les chaines AB accrochées entre elles en une seule chaine. Après une séparation / filtration, une découpe par voie chimique ou enzymatique et la création des ponts sulfure sont réalisées suivies d’une chromatographie par échange d’ions. Une purification finale par chromatographie HP est également nécessaire.
Le génie génétique permet aussi de produire des insulines aux actions différenciées.
Les insulines analogues rapides ou lentes
La fin des années 90 a vu arriver les insulines dites analogues rapides et lentes. Elles sont aussi issues du génie génétique. Elles ont pour objectif de modifier la cinétique ou la solubilité de l’insuline.
Ce sont des insulines très légèrement différentes de l’insuline humaine par changement de quelques aa (addition ou soustraction ou échange) et de quelques adjonctions.
On distingue les insulines analogues rapides, à début d’action plus rapide et durée d’action plus courte que l’insuline humaine (lispro (v), en 1996, asparte (vi) en 2000 ou glulisine (vii) en 2004) qui par juste quelques changements (un aa par un autre) permettent de garder la même action au niveau de la glycémie. La rapidité d’action est due au fait que ce n’est plus l’hexamère qui est formé mais le monomère.
Inversement les insulines analogues lentes ou à action prolongée (glargine (viii) en 2000 et détémir (ix) en 2004) par des modifications d’aa permettent un changement du point isoélectrique. Solubles en milieu acide ces insulines précipitent au pH physiologique et les hexamères formés ont ainsi une durée d’action beaucoup plus longue.
On peut citer quelques fabricants d’insuline dans le monde : Novo Nordisk (danois) leader mondial, Eli Lilly (américain), Sanofi-Aventis (français), Biocon en Inde, Wanbang Biopharma en Chine, Julphar au Moyen Orient…
Proche de nous, on trouve des sites de production d’insuline à Chartres (Novo Nordisk), à Fegersheim (Lilly) et Francfort (Sanofi).
D’après le rapport 2019 de la FID (Fédération Internationale du Diabète), « 578 millions d'adultes seront atteints de diabète d'ici 2030 et 700 millions d'ici 2045 ». On mesure l’importance du savoir-faire indispensable pour la production d’insuline.
Aujourd’hui les axes de recherche dans l’amélioration du traitement sont tournés non plus vers une production d’insuline toujours plus active, mais plutôt dans des injections plus efficaces : pompes en boucle fermée avec mesure en continu de la glycémie et injection en continu d’insuline via l’intervention de l’Intelligence Artificielle (c’est ce qu’on nomme le pancréas artificiel). D’autres nouvelles thérapies sont en cours d’étude : ainsi des cellules souches (implantées directement sous la peau) se transforment en cellules béta des îlots de Langerhans (les cellules pancréatiques productrices d’insuline) et produisent de l’insuline directement utilisable par le corps humain.
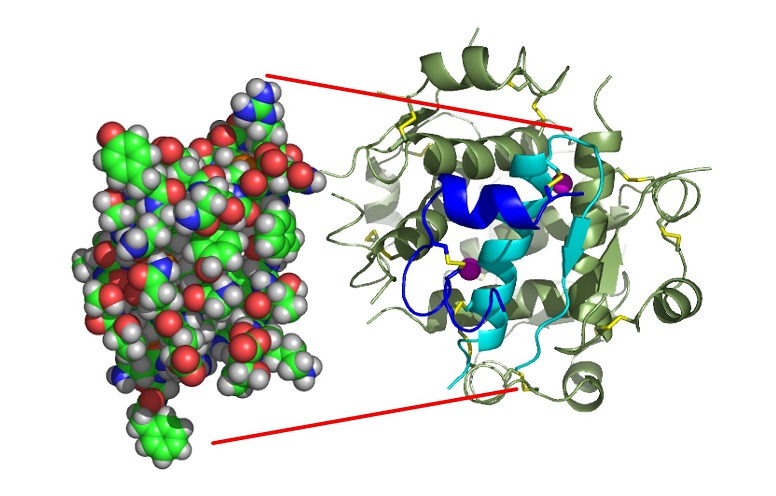
Monomère insuline humaine
(i) En 1922 deux biologistes canadiens Frederick Banting et Charles Best découvrent l’insuline par extraction du pancréas.
(ii) Frederick Sanger a eu le prix Nobel de Chimie en 1958 pour son travail sur la structure des protéines, particulièrement celle de l’insuline.
(iii) Dorothy Hodgkin a eu le prix Nobel de Chimie en 1964 pour « sa détermination par des techniques aux rayons X des structures de substances biochimiques importantes », ce qui lui permit de déterminer la structure tridimensionnelle de l’insuline en 1969.
(iv) Les protamines sont des petites protéines nucléaires (trouvées au centre de noyaux cellulaires) riches en aa arginine.
(v) Insuline lispro : la molécule comporte une inversion de deux aa en bout de chaîne B, qui ne modifie pas la liaison au récepteur, mais bloque la formation de dimères et d'hexamères d'insuline.
(vi) Insuline asparte : c'est une insuline analogue où un seul acide aminé a été modifié, en particulier une proline avec un acide aspartique à la position B28.
(vii) Insuline glulisine : insuline analogue où l’aa asparagine en position B3 est remplacé par la lysine et la lysine en position B29 est remplacée par l'acide glutamique.
(viii) Insuline glargine : remplacement de l'asparagine par la glycine en position 21 de la chaîne A et par l'extension carboxy-terminale de la chaîne B par 2 résidus arginine.
(ix) Insuline détémir : délétion de la thréonine en position B30 et fixation sur la lysine en position B29 de l’acide tétradécanoïque (ou myristique) de formule CH3–(CH2)12–COOH, ce qui lui permet de se complexer à l'albumine dans le sang. Puis lentement le complexe se dissocie et libère l’insuline.
Pour en savoir plus
(1) Histoire de l’insuline : entre le biologique et l’artificiel, G. El Mghari, S.Baki et N. El Ansari, Service d’endocrinologie, Laboratoire PCIM, Université Cadi Ayyad, Marrakech, Hegel vol. 4 n°2 (2014) p. 208 (DOI : 10.4267/2042/53793)
(2) L’insuline produit du jour Société chimique de France
(3) Les 90 ans de la découverte de l'insuline, par la Fédération Française des Diabétiques
(4) Les insulines, médicaments actuels et évolution dans la prise en charge du diabète insulinodépendant, Thèse Alexandre Bitil (2015), tout particulièrement les modes d’obtention pages 21 à 26 (HAL Id : dumas-01171688)
(5) Le génie génétique à la rescousse des diabétiques Musée Armand Frappier Canada
(6) État des lieux passé et actuel de l’insuline (thérapies, procédés) et perspectives d’évolution, Thèse d'exercice en pharmacie (Toulouse) de Delpech Romain (2015)
Crédits :
Illlustration : Monomère insuline humaine par Isaac Yonemoto. Transféré de en.wikipedia.org vers Commons. Premier téléchargement vers en.wp par Takometer, CC BY 2.5, Lien
Figure : Insuline humaine : enchainement des acides aminés et ponts disulfure réalisée par Lydie Amann. DR.
L’article montre comment en 1914 la chimie en France était faible devant celle de l’Allemagne. Il a fallu les premières attaques, sur le front, de gaz toxiques comme le chlore ou l’ypérite pour que se développe une industrie chimique de guerre qui conduira après l’armistice à un renouveau d’une industrie moderne qui deviendra européenne. À côté de l’industrie, de nombreux chimistes chercheurs et universitaires se distinguent pour la défense de la nation ou le soin aux soldats et aux blessés : Marie et Irène Curie, G. Bertrand, A. Haller, A. Behal … sans être exhaustif. Les entreprises chimiques se sont développées dans la ligne dynamique des années de guerre en réorientant leur production pour le temps de paix comme l’on fait les industries métallurgiques et mécaniques. Ce fut aussi le temps ou devant la saignée de jeunes hommes, l’emploi féminin s’est incontestablement développé.
Un encart développe la plupart des molécules constituants les explosifs les plus courants ou sophistiqués.
Source : L’Actualité chimique n° 434 (novembre 2018) pp. 6-10
La formation de l’eau dans notre galaxie daterait de plusieurs milliards d’années. Après la formation du Soleil, le gaz résiduel poussé par le vent solaire se refroidit et se condense pour former des planètes gazeuses constituées au départ d’hydrogène H, d’hélium He, d’ammoniac NH3, de méthane CH4 et d’eau H2O. [...]
Karl Josef Bayer (1847-1904) met au point l’obtention industrielle de l’alumine à partir de la bauxite et participe ainsi au développement ultérieur de l’industrie de l’aluminium. Il travaille, en France, à Gardanne avec Paul Héroult (1863-1914). Ce chimiste autrichien ne doit pas être confondu avec Friedrich Bayer (1825-1880), le fondateur de l’entreprise Bayer.
C’est à Bielitz, en Silésie que nait le 4 mars 1847, Karl Josef Bayer.
Il passe son enfance et son adolescence dans cette ville où il commence des études d’architecture pour faire plaisir à son père alors que ce sont les sciences et en particulier la chimie qui l’attirent. C’est pourquoi, en 1867, il est à Wiesbaben dans le laboratoire de Remigius Fresenius (1818-1897).
Puis, il va à Charleroi en Belgique travailler dans une usine sidérurgique avant de se rendre, en 1869, à Heidelberg, dans le laboratoire de Robert Wilhelm Bunsen (1811-1899). Il étudie le césium et le rubidium qui sont des éléments chimiques trouvés par Bunsen dans le minerai appelé lépidolite. Ils appartiennent tous deux à la famille des alcalins. C’est l’indium qui est l’objet de sa thèse soutenue en 1871. L’indium a été trouvé en quantité infime dans les minerais de zinc et isolé en 1867. De nos jours, il est utilisé sous forme d’oxyde d’indium dans l’affichage à cristaux liquides des écrans plats LCD ( liquid crystal display).
Il obtient un poste d’assistant en chimie à la Technische Hochschule de Brünn en Moravie, l’actuelle Brno en République tchèque. Il fonde, dans cette ville, en 1873, un laboratoire de recherches et de conseils en chimie.
En 1880, il quitte la Moravie pour la Russie où il restera 14 ans. Il travaille à Tentelev près de Saint-Petersbourg dans une usine de colorants pour tissus. Cette usine utilise l’alumine pour teindre les toiles et c’est ainsi qu’il va faire ses premières découvertes concernant l’alumine. Il dépose des brevets en Angleterre en 1888 et en Allemagne en 1889 et une usine est immédiatement construite à Tentelev.
En 1892, il met au point le procédé d’extraction de l’alumine à partir de la bauxite. La bauxite est une roche riche en oxyde d’aluminium. La bauxite doit son nom au minéralogiste et géologue français Pierre Berthier (1782-1861) qui la découvre en 1821 près des Baux-de-Provence. La bauxite broyée est attaquée par la soude à haute température et sous pression conduit après plusieurs étapes à un oxyde d’aluminium, l’alumine. Ce procédé est encore utilisé de nos jours et appelé procédé Bayer.
Puis il part à Ielabouga en Sibérie, actuellement au Tatarstan, où il construit une usine d’extraction de l’alumine.
Il se rend ensuite au Royaume-Uni, aux Etats-Unis et en France afin de réaliser des usines d’extraction de l’alumine. En France, il travaille à l’usine de Gardanne, c’est là qu’il rencontre Paul Héroult (1863-1914).
L’usine de Gardanne a été créée en 1893. Les rapports entre les deux hommes ne sont pas bons, le procédé mis au point par Bayer pose de nombreux problèmes liés aux contraintes industrielles et demande beaucoup d’améliorations.
Alors que Bayer s’intéresse à l’alumine, Héroult profite de la découverte de Bayer pour développer l’obtention de l’aluminium à partir de l’alumine. Ce métal a été obtenu par voie chimique en 1854 par Henri Sainte-Claire Deville (1818-1881) et à cette époque c’est un métal précieux car son prix de revient est élevé.
L’électricité ayant fait de très grands progrès, Héroult obtient de l’aluminium par électrolyse en 1886.
Ce procédé est mis au point la même année par un américain Charles Hall (1863-1914). Actuellement l’aluminium est obtenu par voie électrolytique par le procédé Héroult-Hall. L’aluminium est un métal léger, résistant à la corrosion, excellent conducteur thermique et électrique et recyclable. De nos jours, l’aluminium est utilisé dans les transports, le bâtiment et aussi dans les cuisines.
En 1894, Bayer rentre en Autriche et s’installe à Rietzdorf en Basse-Styrie. Il meurt le 22 octobre 1904.
La Société chimique autrichienne décerne tous les six ans depuis 1961, la médaille Bayer à un chercheur qui s’est illustré dans le domaine de l’aluminium.
Pour en savoir plus :
- Henri Sainte-Claire Deville Les débuts de l’industrie de l’aluminium, Rev. Hist. Sci. Appl., vol.2, n°4 (1949) pp. 352-357
- Produits du jour de la Société Chimique de France (sélectionner alumine et aluminium)
- Réaction en un clin d’œil Comment faire des casseroles avec de la bauxite ?

Karl Josef Bayer
© Davidpop98 / Creationwiki
En 1798 Humphrey Davy (1778-1829) découvrait à Londres les propriétés euphorisantes de l’hémioxyde d’azote, appelé gaz hilarant et, à l’époque gaz nitreux. Il avait été obtenu en 1772 par Joseph Priestley (1732-1804) dans les produits gazeux de décomposition thermique du nitrate d’ammonium. Les informations circulaient vite entre savants, elles parviennent à Madrid où Joseph Louis Proust (1754-1826), avec d’autres chimistes expatriés français, décide de reproduire les expériences
Il en fait le compte rendu en 1802, à son ami Jean-Claude Delaméthrie (1743-1817), médecin encyclopédiste et directeur du Journal de physique à Paris. Sa lettre est publiée : “Je crois vous avoir écrit, docteur, que je me proposois de respirer l’oxyde d’azote pour prendre part à cette riante ivresse, que les chimistes anglais nous ont annoncée”. Il décrit son matériel, “de vastes vessies bien souples, avec des robinets” (ballons fabriqués avec des vessies d’animaux), il élimine une première partie du gaz, suffocante et comparable à l’impression d’une moutarde forte, “et enfin quand il se montre sucré”, il le recueille pour ses expériences. “Dispos, enfin, assis dans mon fauteuil, et plein de confiance, mais pourtant sous les yeux d’une personne qui pût me dire si les changemens qu’elle auroit aperçus s’annonçoient en moi par des signes d’extase ou des grimaces ; je me mis à respirer largement, après avoir évacué d’abord l’air de mes poumons ; mais, où suis-je ? Le trouble de ma vue, un étourdissement qui croissoit, l’anxiété, les objets doubles, la défaillance enfin termina l’expérience. C’en étoit assez. Je me sentois encore si éloigné de cette douce hilarité qui devoit en être la récompense, que la persévérance me manqua tout-à-fait. Moins confiant, cependant dans ma propre expérience, que dans le récit de personnes aussi recommandables que celles qui ont éprouvé les effets de cette inspiration, j’ai répété les épreuves ; mais comme les résultats en ont été les mêmes, avec plus ou moins d’intensité, j’y ai renoncé.”
Longtemps les chimistes ont identifié les produits par leurs propriétés organoleptiques : goût, odeurs, couleurs. Cependant c’est Proust qui a formulé le premier une définition de l’espèce chimique : les corps purs ont une composition élémentaire constante (loi des proportions définies).
La décomposition thermique du nitrate d’ammonium fondu donne l’hémioxyde N2O (+ 2 H2O). L’hémioxyde est souillé de produits d’oxydation, monoxyde NO et dioxyde NO2 monomère et dimère N2O4. De la première partie du gaz qu’il élimine au début de son expérience, Proust affirme : “Ce n’est pas du gaz nitreux ; il mérite d’être examiné”.
Aujourd’hui l’hémioxyde d’azote a des usages anesthésiants médicaux, mais hélas aussi certains s’en servent de drogue légale euphorisante, non sans danger.
Pour en savoir plus :
- lettre du Professeur Proust à J.-C. Delamétherie « Sur l’oxide d’azote respiré », Journal de Physique, de Chimie, d’Histoire naturelle et des Arts, t. LV, 1802, pp. 344-345
- La découverte des propriétés du gaz hilarant par Humphry Davy (1778-1829)

Joseph Louis Proust / Wikimedia
Léon Lefèvre, auteur d’un magistral Traité des matières colorantes organiques artificielles (1896), et fondateur de la Revue générale des matières colorantes, de la teinture, de l’impression et des apprêts, se forma à la recherche en chimie dans le laboratoire d’Édouard Grimaux (1835-1900).
C’est l’époque où le directeur de laboratoire, de savant admiré et lointain, se mue en « patron » se mêlant aux expérimentations de ses élèves et découvrant en même temps qu’eux les résultats : « il considérait ses élèves, dit Lefèvre, comme des amis, discutait avec eux et, chose rare, acceptait leurs avis et même leurs critiques ».
Au décès de Grimaux, Lefèvre le décrit « ardent à la besogne, il développait une activité prodigieuse partagée par ses collaborateurs. […] Je me rappelle encore sa préoccupation lors de son travail sur l’oxydation de la glycérine (glycérol ou propane-1,2,3-triol) qui lui fit découvrir le premier, un sucre synthétique fermentescible (le glycéraldéhyde, premier terme des aldoses). Le soir nous mettions en fermentation le précieux produit, et il fallait attendre le lendemain pour voir s’il y avait production de gaz carbonique. A sept heures du matin, le « patron » accourait au laboratoire : ô bonheur ! Il y avait plusieurs centimètres cubes de gaz. Toute la journée, ceux qui entrèrent au laboratoire furent salués de ces deux mots : « ça fermente ! » et chacun de rendre visite au tube à fermentation.
Le chimiste Édouard Grimaux (1835-1900) fut successivement pharmacien, médecin, professeur à l’Institut national agronomique et à l’École polytechnique, où, le premier, il introduisit dans ses cours la notation atomique. Sa thèse de médecine, préparée à Sainte-Hermine en Vendée dans sa pharmacie, portait sur le hachisch. Selon Georges Clemenceau (1841-1926), futur homme politique sous la IIIe république, qui était son ami et le voyait quotidiennement, pour mieux connaître son sujet il expérimentait sur lui et notait les effets de différents extraits : « Grimaux se « hachischait » en conscience et y gagnait de terribles maux d’estomac, sans cependant avoir les visions paradisiaques promises dans les livres ». Malgré son désespoir, Clemenceau s’est refusé à contribuer à l’expérimentation qu’il jugeait incompatible avec ses tâches de jeune médecin.
Grimaux est le premier biographe de Lavoisier.
En 1898 il fut l’un des chefs de file des intellectuels engagés en faveur du capitaine Dreyfus dans la crise politique majeure qui a affecté la France entre 1898 et 1900, et l’un des deux premiers vice-présidents de la Ligue des droits de l’homme avec Émile Duclaux (1840-1904), directeur de l’Institut Pasteur.
Pour en savoir plus :
- notice Grimaux, in Itinéraires de chimistes (SCF-EDP Sciences) 2007
- J. Fournier, Édouard Grimaux Un grand savant vendéen, édité par Les amis du temple protestant de Sainte-Hermine et Histoire et patrimoine du canton de sainte-Hermine, 2012, 46 p.

Édouard Grimaux
photo : A. Gerschel et fils, coll. École polytechnique
Adolf Lieben (1836-1914), chimiste autrichien, vient à l’école de médecine de Paris où il travaille dans le laboratoire de Charles Adolphe Wurtz (1817-1884) puis se rend en Italie grâce à Stanislao Cannizzaro (1826-1910). À son retour en Autriche, il réalise de nombreuses synthèses organiques comme celles des trihalogénométhanes qui seront utilisées dans l’industrie. Il reçoit la médaille Lavoisier de l’Académie des sciences de Paris en 1905.
Adolf Lieben est un chimiste autrichien, né à Vienne le 3 décembre 1836.
Il commence ses études à Vienne puis part à Heidelberg où il travaille dans le laboratoire de Robert Wilhelm Bunsen (1811-1899), où il obtient son doctorat en 1856. L’Université d’Heidelberg, fondée en 1386 par Robert 1er, électeur palatin et refondée en 1803 par Charles 1er de Bade, est la plus ancienne d’Allemagne
Dans la seconde moitié du XIXème siècle, Bunsen a contribué à faire de Heidelberg, un centre important pour la chimie. Un brûleur à gaz encore très utilisé de nos jours dans les laboratoires porte son nom, le « bec Bunsen ».
Lieben vient ensuite à Paris où il poursuit sa formation auprès de Charles Adolphe Wurtz (1817-1884) au laboratoire de l’École de médecine de Paris. Wurtz a accueilli de nombreux étrangers dans son laboratoire, son nom, comme celui de soixante et onze savants est inscrit sur la Tour Eiffel (face La Bourdonnais). Lieben conservera un très bon souvenir de cette période puisqu’en 1881, les anciens « élèves » de Wurtz, lors de sa nomination au Sénat, lui offriront une statue de Bernard Palissy (1510-1589) en bronze sculptée par Louis Ernest Barrias (1841-1905) et sur le piedestal duquel figurent cent onze noms dont celui de Lieben.
En 1860, Wurtz et Lieben se rendent au premier congrès scientifique, réunissant des chimistes, qui se déroule à Karlsruhe du 3 au 5 septembre. Lieben y rencontre le chimiste italien Stanislao Cannizzaro (1826-1910).
En 1861 il est Privatdozent à l’université de Vienne. Puis Grâce à Cannizzaro, Lieben obtient le poste de professeur de chimie à l’université de Palerme en 1863 puis à Turin en 1867.
Enfin, il est nommé à l’université de Prague en 1871. Cette université a été fondée le 7 avril 1348, c’est la plus ancienne d’Europe Centrale et aussi la plus ancienne université de langue allemande car à sa fondation, Prague était la capitale du Saint-Empire romain germanique.
Il regagne Vienne en 1875 et jusqu’en 1906, il occupe la chaire de chimie générale et pharmaceutique. En 1922, un buste est placé dans la cour à arcades de l’Université et un autre dans l’institut de chimie de Vienne.
Son travail porte essentiellement sur la chimie organique. Il réalise la synthèse des alcools, des aldéhydes, des acides et des hydrocarbures. Il met au point la réaction haloforme encore appelée réaction de Lieben. Le chlore, le brome, l’iode et le fluor sont classés dans la famille des halogènes d’où le nom de la réaction. Cette réaction chimique permet la synthèse des trihalogénométhanes, tels que le chloroforme, l’iodoforme et le bromoforme. Cette réaction a été utilisée industriellement.
Il est membre de l’Académie des sciences de Vienne. Son père Ignaz (1805-1862) lègue une partie de sa fortune à l’Académie des sciences et de 1863 à 1938, l’Académie décerne un prix récompensant un jeune scientifique en physique, chimie ou biologie. Ce prix est remis tous les trois ans de 1863 à 1900 à un scientifique de l’Empire austro-hongrois qui reçoit une somme de 900 florins. De 1900 à 1938 , le prix devient annuel mais est supprimé après l’Anschluss.
Depuis 2004, grâce au soutien financier d’Alfred Bader (1924- 2018) qui a fui Vienne en 1938 pour le Royaume-Uni, et de sa femme Isabel (1926- ), le prix est, à nouveau, décerné chaque année à un jeune scientifique travaillant dans un des pays de l’ancien Empire austro-hongrois.
Lieben est membre de plusieurs sociétés savantes européennes mais pas de l’Académie des sciences de Paris. De nombreuses notes figurent dans les comptes rendus de l’Académie et la commission composée de Louis Troost (1825-1911), Henri Poincaré (1854-1912), Gaston Darboux (1842-1917) et du rapporteur Marcellin Berthelot (1827-1907) propose, le 18 décembre 1905, d’attribuer la médaille Lavoisier à Lieben. L’Académie suit la conclusion du rapport et décerne la médaille à Lieben.
Il reçoit en même temps la médaille Berthelot car depuis 1902, l’Académie des sciences décerne cette médaille à un chimiste qui a obtenu un prix.
Adolf Lieben meurt à Vienne le 6 juin 1914, il est enterré au cimetière de Döblinger.
Anton von Schrötter (1802-1875) mit au point en 1848 la préparation du phosphore rouge, permettant une fabrication sûre des allumettes. Le prix Montyon de l’Académie des sciences de Paris lui a été décerné en 1857.
Anton von Schrötter, Chevalier de Kristelli, est né à Olmütz en Moravie (actuellement Olomouc en République tchèque) le 26 novembre 1802. Son père est pharmacien et son grand-père maternel a été maire d’Olmütz. Il a bien défendu cette ville durant la guerre de sept ans, c’est pourquoi l’Impératrice Marie-Thérèse l’a fait chevalier.
Après une enfance à Olmütz, Anton part à Vienne en 1822 afin de commencer des études de médecine. Mais, il rencontre Friedrich Mohs (1773-1839), professeur de minéralogie, et sous son influence, abandonne alors la médecine pour entreprendre des études de sciences naturelles. Friedrich Mohs est connu pour son travail sur la dureté des minéraux, pour lesquels il a conçu une échelle de dureté en 1812, encore utilisée de nos jours.
En 1827, Anton von Schrötter devient assistant à l’Université de Vienne et en 1830, il est nommé professeur de physique et de chimie à l’institut technique Joanneum à Graz. En 1838, il prend un congé de six mois afin de visiter des laboratoires universitaires et s’arrête entre autre à Göttingen, Heildelberg et Paris. À son retour à Graz, il crée un laboratoire.
En 1843, il revient à Vienne comme professeur de génie chimique à l’Institut polytechnique, et c’est en 1845 qu’il est enfin nommé à la chaire de chimie générale.
En 1848, il découvre le procédé pour préparer du phosphore rouge ce qui conduira à l’allumette de sûreté. Le phosphore se présente sous plusieurs formes. Dans la nature, le phosphore est blanc, transparent lorsqu’il est pur, luit dans l’obscurité et brûle en donnant de la lumière. Il a été utilisé pour la fabrication des allumettes mais il est très toxique. Les vapeurs inhalées par les ouvriers des fabriques d’allumettes entrainent une nécrose des os de la mâchoire. Des empoisonnements au phosphore ont eu lieu. Anton von Schrötter découvre que le phosphore blanc se transforme en phosphore rouge sous l’influence de la chaleur vers 250°C. Ce phosphore n’est pas toxique et est peu inflammable, c’est pourquoi sa découverte est importante, il n’est pas dangereux pour les ouvriers et ne peut donner lieu à des empoisonnements.
Pour la fabrication des allumettes, des essais sont réalisés en utilisant du phosphore rouge. Le phosphore est mélangé avec du chlorate de potassium puis des améliorations sont apportées, le chlorate est mis sur la tige et le phosphore sur le frottoir.
En 1873, lors de l’exposition universelle de Vienne, l’industrie des allumettes est représentée par l’Autriche, la France et la Suède. En France, c’est la Compagnie générale des allumettes chimiques qui a le monopole. Au début des années 1870, la Compagnie utilise 360 tonnes de phosphore rouge par an et fabrique 70 milliards d’allumettes, elle exporte au Japon, au Guatemala, au Pérou et en Argentine.
En France, dès 1850, Antoine Bussy (1794-1882) teste sur un chien le phosphore rouge et constate qu’il n’a aucune action toxique.
L’Académie des sciences de Paris décerne le prix Montyon le 2 février 1857 à Anton von Schrötter pour sa découverte de l’état isomérique du phosphore rouge. Le prix Montyon est un ensemble de trois prix, l’un de ces prix est décerné par l’Académie des sciences. Ce prix a été créé par Jean-Baptiste Auget de Montyon (1733-1820) entre 1780 et 1787, il a été supprimé par la Révolution et rétabli en 1815. Ce prix est de 2500 francs.
À Vienne, l’Académie des sciences est fondée le 14 mai 1847 par le roi Ferdinand 1er d’Autriche et Anton von Schrötter en est le secrétaire général dès 1851.
L’expédition Novara (1857-1859) est une expédition scientifique à laquelle participe les membres de l’Aca- -démie des sciences de Vienne. La frégate Novara a fait le tour du monde en 551 jours de navigation. Les rapports de ce voyage ont été publiés dans un ouvrage de 21 volumes et traduits en plusieurs langues, les résultats concernent de nombreux domaines scientifiques comme l’océanographie, la botanique ….
En 1873, une autre expédition donne le nom de Franz Josef Land à un archipel situé à l’extrême nord de la Russie et un cap est nommé cap Schrötter. Son nom est aussi associé à la Schrötterhorn de l’Ortlergruppe dans les Alpes.
Il meurt à Vienne le 15 avril 1875 où il est enterré au cimetière central.
