En raison de la probabilité de circulation concomitante cet hiver des virus grippaux et de la Covid-19, la Haute Autorité de Santé (HAS) recommande de coupler les campagnes de vaccination contre la grippe et la Covid-19 à partir du 18 octobre 2022.
Plusieurs ressources ont fait le point sur les vaccins en général et sur le coronavirus (1). Le lecteur pourra s'y reporter. Rappelons que les vaccins dont nous allons parler ici sont des vaccins prophylactiques (2), et non thérapeutiques (3).
1. Le vaccin antigrippal
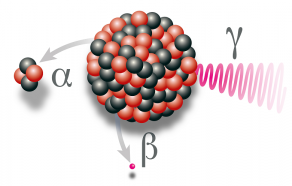
La grippe est une maladie respiratoire et aiguë qui est de retour chaque automne et ne disparaît qu’au printemps. Appartenant à la famille Influenza, les virus à l’origine de cette maladie sont de type A, B ou C.
Le vaccin contre la grippe est fabriqué à partir de virus inactivés et fragmentés. Il ne contient pas de virus vivant, et ne présente aucun risque de transmettre la grippe. L’organisme, au contact de ces fractions rendues inoffensives, va développer des anticorps, défenses immunitaires spécifiques qui le protégeront face au virus environ 15 jours après la vaccination.
Quelle est la composition du vaccin 2022-2023 ?
Les virus grippaux étant très changeants, il faut adapter chaque année le vaccin aux virus susceptibles de circuler (4) et revacciner chaque année. Le vaccin antigrippal pour l'hiver 2022-2023 cible les virus appartenant aux quatre différentes souches suivantes : un virus de type A/Victoria/2570/2019 (H1N1) ; un virus de type A/Darwin/9/2021 (H3N2) ; un virus de type B/Austria/1359417/2021 ; un virus de type B/Phuket/3073/2013.
On connaît déjà bien les virus H1N1 et H3N2, responsables essentiels de la grippe de 2018 caractérisée par 8 semaines d’épidémie en France et à l’origine de 1,8 million de consultations, de 65 600 passages aux urgences, de 11 000 hospitalisations et de 8100 décès (5).
Comment fabrique-t-on le vaccin contre la grippe ?
Les vaccins vivants atténués sont utilisés depuis 1921 comme le célèbre BCG (6) contre la tuberculose. Depuis une cinquantaine d'années, on fabrique les vaccins à l'aide d'œufs fertilisés. On injecte le virus par un petit trou à l'intérieur de ces œufs qui sont incubés 3 jours à 35°C. Le virus se multipliera à l'intérieur des cellules qui composent l'embryon de poulet. Une nuit à 5°C fait mourir les embryons, puis on récupère et purifie le blanc d'œuf. On tue alors le virus - et les bactéries éventuellement présentes - à l'aide d'un produit chimique (7), puis on purifie ces virus inactivés qui sont ensuite fragmentés (8), ce qui augmente la réponse immunitaire et diminue encore les risques. Le vaccin est alors prêt.
2. Le vaccin contre la COVID-19
Cette année en France, la Haute Autorité de Santé a recommandé des vaccins bivalents (9) qui protègent contre la souche initiale SARS-CoV-2 et son variant Omicron. Ce sont des vaccins à ARNm (10) dirigés contre les protéines de pointe (11) des virus. Les vaccins précédents restent efficaces contre les formes graves, les hospitalisations et les décès, mais les vaccins bivalents sont mieux adaptés aux virus qui circulent actuellement et peuvent éviter l'infection.
Le vaccin à ARNm est-il sans danger ?
La figure 1 montre comment la cellule eucaryote (12) va fabriquer les protéines : une cellule se compose d'un cytoplasme (13) à l'intérieur duquel est le noyau, séparé par une membrane difficile à franchir. À l'intérieur du noyau, l'ADN porteur de l'information génétique va être copié, c'est la réplication ; cet ADN va être reproduit sous forme d'ARN c'est la transcription ; cet ARN va perdre des fragments non utiles, c'est l'épissage qui conduit à l'ARN messager. Ce dernier traverse la membrane pour passer dans le cytoplasme, où il est traduit en protéines.

Figure 1.
Pour préparer le vaccin, comme l'ARNm est détruit dès qu'il pénètre dans l'organisme, on enveloppe l'ARNm fabriqué par synthèse (14) et codant pour les fragments de protéine de pointe dans une membrane artificielle (15) qui mime la membrane externe de la cellule. Lors de la vaccination, ce vecteur va pénétrer dans le cytoplasme où il introduit l'ARNm, mais il ne peut pas pénétrer dans le noyau. Il n'y a donc a priori pas de risque de modification du génome.
Mais ce premier vaccin à ARNm, préparé si vite, est-il vraiment sûr ? Il y a plusieurs arguments qui montrent que sa préparation n'a pas été « bâclée » :
- i) Depuis 1990, une chercheuse hongroise, Katalin Karikó, a proposé d'utiliser l'ARNm dans des buts thérapeutiques (16)
- ii) Ce nouveau type de vaccin a bénéficié des études de 2003 lors de l'épidémie de SARS CoV-1
- iii) La synthèse du fragment d'ARN codant pour un fragment de la protéine de pointe a été très rapide, ce qui a accéléré les choses par rapport aux vaccins classiques
- iv) La circulation très rapide du virus a permis d'obtenir des résultats plus rapidement.
3. Co-vaccination grippe Covid : est-ce sans danger ?
Selon une étude de Santé publique France (17), 25 % des personnes à risque comptent faire les deux vaccins en même temps. Dans un communiqué, l'Assurance maladie rassure : « la co-vaccination est sans danger : les données disponibles indiquent que la co-administration est généralement bien tolérée ». D'ailleurs, lors de la campagne de vaccination contre la grippe 2021-2022 qui était couplée avec celle contre la Covid-19, « aucun signal particulier n’a été identifié ». En cas d'impossibilité ou de refus de recevoir les deux vaccins en même temps, aucun délai n'est à respecter entre deux vaccinations.
Une question assez curieuse se pose : « pourquoi les gens ont-ils plus peur des vaccins que des médicaments ? " Il semblerait que ce soit d'abord la peur de la seringue ! Et le vaccin est une invention récente, du XIXe siècle, alors que l'homme se soigne avec des emplâtres, des tisanes depuis plus de mille ans. Enfin, de tout temps les hommes ont été plus préoccupés par la guérison des maladies que par leur prévention.
Nicole Jeanne Moreau et l’équipe Question du mois
(1) Zoom sur les vaccins (02/10/2020) ; Ensemble de ressources et de liens relatifs au coronavirus SARS-CoV-2 et à la pandémie de COVID-19 (mediachimie.org)
(2) Pour prévenir ou atténuer les effets d'une éventuelle infection par un agent pathogène naturel.
(3) Pour soigner ou aider le patient à lutter contre une maladie déjà survenue, par exemple un cancer.
(4) C’est l’Organisation mondiale de la santé (OMS) qui est chargée, en amont, de leur surveillance.
(5) Selon Santé publique France
(6) Bacille de Calmette et Guérin
(7) Formaldéhyde et/ou détergent
(8) Les vaccins à virions fragmentés contiennent des virus inactivés, qui ont été fragmentés au moyen d’un détergent, d’un solvant ou de ces deux substances. Réf: https://www.canada.ca/fr/sante-publique/services/rapports-publications/releve-maladies-transmissibles-canada-rmtc/numero-mensuel/2018-44/numero-6-7-juin-2018/article-2-resume-vaccin-sous-unitaire-vaccin-antigrippal-virion-fragmente.html
(9) Moderna ou Pfizer-BioNTech
(10) ARN messager
(11) Spicule ou spike
(12) Du grec eu, bien et caryos, noyau. Ce sont les cellules de tout être vivant autre que les bactéries.
(13) Du grec cyto, cellule et plasma, forme
(14) Ils sont synthétisés in vitro à l’aide d’une matrice d’ADN et d’une enzyme, l’ARN polymérase. L’ARN est ensuite purifié sur des colonnes de chromatographie, qui profitent des propriétés chimiques (pH ou affinité) pour séparer les composants de la solution et isoler le produit d’intérêt.
(15) Formée de lipides, de phospholipides et de cholestérol
Exemple de l’excipient du vaccin Pfizer :

source : wikipedia, domaine public, Lien
(16) Elle rejoint en 2013 BioNTech, un des deux laboratoires, avec Moderna, à l'origine du vaccin.
(17) https://www.has-sante.fr/jcms/p_3288855/fr/covid-19-et-grippe-la-has-precise-les-conditions-d-une-co-administration-des-vaccins
Crédits. Illustration : MasterTux/Pixabay ; Figure 1 : © N.J. Moreau
Le principe de la bougie, vieux comme le monde, consiste en un corps gras (combustible) et une mèche inflammable.
Lorsqu’on enflamme la mèche, la chaleur dégagée fait fondre le corps gras. Ce liquide cireux va alors grimper le long de la mèche par un phénomène appelé capillarité et se vaporiser sous l’action de la chaleur. Les gaz formés brûlent au contact du dioxygène de l’air : c’est la flamme de la bougie.
Cette combustion consomme la cire et le dioxygène et elle dégage de la chaleur. Elle va donc permettre la fonte de la cire restante et fournir en continu l’apport en combustible dans la mèche, ce qui entretient le processus, bien que la mèche se consume peu à peu.
En l’absence d’air (donc de dioxygène) - ou de mèche - la bougie s’éteint.
Les composants des bougies
Historiquement, la mèche était un jonc, il était trempé dans de la graisse fondue animale, suif de bœuf ou de mouton, graisse de cochon… ou cire d’abeille (beaucoup plus coûteuse et essentiellement réservée aux usages religieux) qu'on laissait ensuite durcir.
L’identification au début du XIXe siècle de la stéarine (i) extraite de graisse animale ou végétale et dont l’acide stéarique est issu puis, à la fin de ce siècle de la paraffine solide, issue du pétrole, a permis la production industrielle des bougies, formées avec des mèches en coton ou en chanvre tressé entourées d’une cire pouvant être moulée et solide à température ordinaire. Lors de leur fabrication, les bougies peuvent être colorées, si l’on introduit des pigments, ou parfumées par exemple par des huiles essentielles.
Les températures de fusion varient selon les produits utilisés. La température de fusion de la paraffine se situe entre 52 et 56°C, celle de l’acide stéarique est de 69-70°C et celle de la cire d’abeille se situe entre 62 et 65°C.
De nos jours, les bougies commercialisées sont essentiellement fabriquées à partir de paraffine.
Les constituants chimiques
Les graisses végétales ou animales sont composées de triesters du glycérol et d’acides à très longue chaine carbonée appelés acides gras (ii). Ainsi, la stéarine est le triglycéride de formule C57H110O6) (iii) dont on tire l’acide stéarique de formule CH3-[CH2]16-COOH. C’est l’acide stéarique qui a permis la production à grande échelle de bougies tout au cours du XIXe siècle (iv).
La paraffine est un mélange obtenu en raffinerie à partir de résidus solides du pétrole. Elle est constituée d’alcanes, molécules d’hydrocarbures saturés, de formule brute CnH2n+2, où la valeur de n se situe entre 18 et 32.
La paraffine qui est utilisée dans la production industrielle de bougies est en général complétée par l’apport d’un mélange appelé « acide stéarique technique » composé d’acides palmitique(v)et stéarique, et improprement appelé « stéarine »(vi). Ce mélange permet de rendre la cire plus opaque, plus dure ou encore d’augmenter la durée de combustion de la bougie.
La cire d’abeille est un mélange naturel complexe dont les constituants chimiques ne sont pas tous identifiés. Elle est composée d'environ 15% d'hydrocarbures linéaires à longues chaînes, 71% d'esters (dont 44% de monoesters d'acide gras et d'alcool gras, 12% d'hydroxyesters, 14% de di et triesters et 1% d'esters de stérols), 3% d'acides libres (vii) et 1% d'alcools libres, auxquels s’ajoutent des composés variables selon l’origine de la ruche.
La combustion de la bougie
La combustion complète des substances constituant une bougie conduit à la formation de CO2 et H2O. Mais si elle est incomplète, par manque d’oxygène elle produit aussi du monoxyde de carbone CO et des dépôts de carbone (suie).
De plus, une fois chauffés, la paraffine et les éventuels adjuvants parfumés ou colorés libèrent un peu de substances (acétone, benzène, toluène) toxiques et agressives pour les poumons. La combustion d’une bougie parfumée donne aussi naissance à des particules ultrafines associées à des HAP, hydrocarbures aromatiques polycycliques que l’on retrouve lors d’une combustion incomplète, et dont la toxicité est connue.
S’il y a de la fumée ou de la suie visibles, c’est que la bougie contient des substances polluantes.
La cire d’abeille ne dégage pas de fumée en brûlant ce qui donne des bougies moins polluantes.
Il est donc conseillé d’utiliser les bougies dans un milieu suffisamment aéré pour profiter de la magie qu’elles offrent.
Andrée Harari, Françoise Brénon et l’équipe question du mois
(i) La stéarine a été découverte par Michel Eugène Chevreul au XIXe siècle lors de ses travaux sur les corps gras entre 1813 et 1823. Voir son traité Recherches chimiques sur les corps gras d’origine animale (sur le site Gallica -BNF)
(ii) Un acide gras est un acide carboxylique dont la chaine carbonée présente de 4 à 36 atomes de carbone.
(iii) La stéarine est le triester formé à partir du glycérol (ou propan-1,2,3-triol) HOH2C–CHOH–CH2OH et de l’acide stéarique CH3-[CH2]16-COOH. Sa formule développée est :

Domaine public, Lien
(iv) M. E. Chevreul et J. L. Gay-Lussac avaient entrevu l’innovation issue de leurs travaux d’isolement des acides gras, en particulier de l’acide stéarique, et avaient pris un brevet pour la réalisation de la bougie stéarique au cours des années 1830. Source « Des produits chimiques très recherchés: les acides gras pour la fabrication des bougies. La naissance de la lipochimie industrielle au cours du XIXe siècle », Gérard Emptoz, Culture technique, n° 23 (1991), pp. 33-45.
(v) L’acide palmitique a pour formule CH3(CH2)14COOH
(vi) Voir la définition du dictionnaire Larousse
(vii) Sources "Manuel des corps gras", Technique et Documentation, Lavoisier, Paris, 1992, pages 297 et 306 et Cires et cirages E. Gomez § 2.2.2.
Pratiquement un quart de la cire d'abeille est du palmitate de myricyle C15H31-COO-C30H61 et on trouve également une quantité de l'ordre de 12% de cérotate de myricyle C25H51-COO-C30H61.
Pour en savoir plus
[1] Histoire d’une chandelle, de M. Faraday : pages 29 et suivantes (J. Hetzel (Paris) Ed.) (sur le site Gallica - BNF)
[2] Pour les différents parties éclairantes de la flamme, l’article : The candle, the light bulb and the radio, de R. de Hilster, CNPS Proceedings 2017, p. 13
Crédits illustration : DR. A. Harari pour Mediachimie
C’est un problème de santé publique et aussi de chimie analytique !
Nous avons besoin de sel (chlorure de sodium de formule NaCl) pour maintenir constant notre équilibre électrolytique : c’est-à-dire les rapports entre les concentrations des différents ions (sodium, potassium, chlorure, calcium, magnésium, phosphate) et l’eau contenus dans notre organisme. Or on perd du sel dans l’urine et la sueur et c’est pourquoi nous devons consommer du sel. Si le sel est vital pour notre organisme un excédent de sel entraine une augmentation de la pression artérielle conduisant à des maladies cardiovasculaires et des AVC. Il est à signaler que l’organisme a besoin d’un minimum de sel pour bien fonctionner car si nous n’en absorbions pas du tout les effets de toxicité seraient les mêmes que ceux décrits lors d’une trop grande consommation. L’OMS recommande de diminuer la consommation de sel depuis une dizaine d’années pour atteindre un objectif de 30% de baisse en 2025.
Pour réduire la consommation en sel, il faut : i) diminuer la dose journalière qui est située actuellement entre 6,5 et 12,5 g de sel/jour, ii) réduire le taux de sel dans les aliments consommés, iii) réduire l’usage du sel de table, en ne dépassant pas le taux de 1,5 % en masse d’aliment, iv) abaisser l’optimum de préférence au goût en utilisant par exemple des arômes de cacahuète ou des ajouts d’herbes aromatiques (persil, basilic, origan… qui renforcent la perception du sel. Des tests sont actuellement en cours sur l’utilisation des différentes variétés de sel (sel fin, fleur de sel, sel micronisé) [1].
La saveur salée fait partie des cinq saveurs fondamentales dont l’amer, l’acide, le salé, le sucré et l’unami (qui vient du japonais : goût protéine des viandes). Leur carte de répartition n’est pas localisée dans des zones précises de la langue contrairement à une idée répandue jusque dans les années 70 [2]. La saveur salée est perçue par toutes les papilles de la langue par un mécanisme transmembranaire qui déclenche un influx nerveux transmis au cerveau nous permettant d’apprécier cette saveur. Les seuils de détection varient avec l’âge de 0,3 g/L pour les juniors à 0,8 g/L pour les seniors, sans différence observable entre les hommes et les femmes. Mais il n’y a pas que le cation sodium du chlorure de sodium qui est responsable de la saveur salée : l’ion potassium, le lithium (non consommable) et l’ion ammonium participent aussi à cette saveur. Le chlorure d’ammonium est utilisé dans les pays du Nord où les rennes sont domestiqués de cette manière car ils en raffolent !
Disposer de mesures précises de la teneur en sel de nos aliments est donc nécessaire.
Des observations qualitatives de fluorescence ont montré que le sel pénètre peu dans la viande grillée de bœuf mais assez profondément dans la chair du poulet cuit [1] .
Des mesures IRM (imagerie par résonance magnétique) issues de la résonance magnétique nucléaire (RMN) du sodium (23Na), nécessitant d’utiliser des champs magnétiques forts de l’ordre de 4,7 teslas (environ cent mille fois le champ magnétique terrestre !) permettent de doser avec une grande précision la teneur en sodium des aliments [1]. Par exemple on a pu mesurer exactement la quantité de sel dans des jambons après un séchage de plus de six mois (8 g de sel pour 55 g d’eau !) Mais cette méthode permet aussi d’obtenir une cartographie de la répartition du sel à l’intérieur des aliments (sans la destruction de cet aliment). Des carottes cuites dans des solutions classiques de cuisine ont été analysées et la concentration du sel au bord des carottes est égale à 7,2 g/L tandis qu’à l’intérieur de la carotte elle est deux fois plus faible ! Une étude plus fine des formes des spectres montre l’existence d’ions sodium libres mais aussi d’ions sodium liés aux molécules voisines contenues dans l’aliment, ce qui donne des informations sur la relation entre la saveur salée plus ou moins longue en bouche et la nature des aliments !
À noter que l’emploi du glutamate de sodium comme alternative au chlorure de sodium fait encore l’objet actuellement de travaux de recherche car il est responsable des saveurs : salée mais aussi unami !
Jean-Pierre Foulon et l'équipe Question du mois
Note : L’IRM du sodium est aussi utilisée avec succès pour doser les ions sodium dans le cerveau humain (travaux de recherche réalisés à l’hôpital de Marseille en 2022 !) permettant des diagnostics médicaux très précieux.
Pour en savoir plus :
[1] Comment réduire le sel dans notre alimentation ? série de cinq conférences vidéos par H. This, C. Hugol-Gential, J.M. Bonny, T. Thomas-Danguin, J.P. Poulain, en libre accès sur le site de l’Académie de l’agriculture, séance 19/10/2022
[2] Le goût : de la molécule à la saveur, Loïc Briand, in La chimie et les sens (EDP Sciences, 2018) pp. 189-209 ; vidéo et chapitre du Colloque La chimie et les sens (22 février 2017).
Crédits : image d'illustration, licence CC0, PxHere
La molécule de formule NH3 appelée ammoniac(i) est un gaz, très soluble dans l’eau. On donne aussi le nom d’« ammoniaque » ou « solutions ammoniacales » à ses solutions aqueuses.
La forme gazeuse est présente à l’état naturel lors de la décomposition de substances protéiques. 80% de sa production industrielle par le procédé Haber-Bosch(ii) sert à la synthèse des engrais.
Pour ce qui est des applications domestiques, on trouve la solution aqueuse en magasin de bricolage, dans les rayons de produits ménagers ou sur Internet, avec les informations d’utilisations suivantes « nettoyant, décapant », « dégraisse, détache les tissus, ravive les couleurs », « nettoyer les tapis et moquettes, nettoyer les surfaces vitrées… ». Il existe aussi des mélanges prêts à l’emploi.
En ce qui concerne le nettoyage de l’argenterie, l’utilisation des solutions d’ammoniac est discutable(iii).
La solution d’ammoniac est également une des composantes utilisée pour réaliser des « frisures permanentes » sur cheveux(iv), ou dans des colorations capillaires.
Les noms rencontrés sur les étiquettes du commerce
Ammoniaque alcali 22° baumé ; ammoniaque 13° ; ammoniac 13% ; ammoniaque alcali 13 % ; alcali 13% ; ammoniaque (ou ammoniac) alcali 22° hydroxyde d’ammonium ref alcali en solution à 20% (en poids d’ammoniaque dans l’eau).
Ces noms recouvrent-ils la même chose et quelles sont les significations de toutes ces informations ?
Que se passe-t-il lors de la dissolution de l’ammoniac gazeux dans l’eau ?
Lors de la dissolution du gaz ammoniac dans l’eau il s’établit un équilibre dont l’équation bilan (A) est la suivante :
(A) NH3 (aq) + H2O (l) = NH4+(aq) + OH-(aq)
Mais cet équilibre ne produit qu’une très faible quantité d’ions ammonium NH4+. Ainsi la solution contient très majoritairement des molécules d’ammoniac hydratées. Par exemple, pour 17 g de gaz ammoniac NH3 dissout dans 1 L d’eau cela conduit à l’équilibre à avoir 99,6 % sous forme NH3,aq(v). Il se forme seulement 0,4 % sous forme NH4+ et simultanément la même faible quantité d’ions hydroxyde OH-.
Ainsi écrire que l’ammoniaque (correspondant à l’ammoniac en solution) aurait pour formule chimique NH4OH est donc inexact et source d’erreur(vi). Cette formulation date du XIXe siècle(vii).
La solution aqueuse d’ammoniac est aussi une solution basique en raison de la présence des ions OH-(viii).
Le mot « alcali » a pris plusieurs définitions au cours des siècles. En tant qu’adjectif il signifie que le produit est une base forte et donc que sa solution a concrètement un pH allant de 10 à 14 selon sa concentration(ix), ce qui est le cas de la solution d’ammoniac. En tant que nom, « l’alcali » ou « alcali volatil » est synonyme de solution d’ammoniac. Ce terme est toutefois désuet.
Pourquoi l’ammoniac peut-elle retirer des taches de couleurs ?
L’ammoniac NH3 peut donner des complexes en s’associant aux molécules responsables de la tache et ainsi « l’encapsuler » ou faire passer sous forme ionique un colorant qui sera alors soluble dans l’eau. Son caractère basique participe aussi au processus de dégraissage.
Ces propriétés étaient utilisées dès l’Antiquité ! À Pompéi et dans la Rome antique il existait des ateliers de foulonnerie où l’on nettoyait les vêtements des dignitaires. Le linge était foulé avec les pieds par des esclaves dans des bacs contenant des argiles et de l’urine humaine récoltée dans la ville. En effet l’urine contient de l’urée qui se transforme en ammoniac grâce à une enzyme uréase (naturellement présente dans l’urine) selon :
(NH2)2CO (urée) + H2O → CO2 + 2 NH3
Précautions à prendre dans un usage domestique(x)
En raison de son caractère basique, il est conseillé d’utiliser des gants lors de la manipulation d’une solution aqueuse d’ammoniac et d’éviter le contact avec les yeux et les muqueuses.
L’odeur caractéristique de l’ammoniac ne vous échappera pas ! Au moment de manipuler ce produit il est vivement conseillé d’ouvrir les fenêtres pour aérer la pièce et d’éviter de respirer les vapeurs.
Ne pas stocker ni manipuler le produit près d’une source de chaleur, car NH3 dissous peut facilement redonner de l’ammoniac gazeux s’échappant du flacon.
Ne pas stocker la bouteille d’ammoniac à proximité d’une bouteille d’acide chlorhydrique (éventuellement possédée comme détartrant). En effet les vapeurs de NH3 comme celles de chlorure d’hydrogène (HCl) pouvant s’échapper des flacons donneront des cristaux blancs de chlorure d’ammonium(xi), qui se déposeront sur les bouchons. On peut observer que les grandes surfaces ne respectent pas toujours ces règles de stockage !
Dans diverses circonstances vous pouvez identifier la présence d’ammoniac. Par exemple :
- L’ammoniac apparait dans des processus de fermentation réalisés dans l’industrie agroalimentaire. Ainsi les caves d’affinage du Comté se distinguent par une forte odeur due à des vapeurs d’ammoniac(xii).
- Le Hákarl, plat traditionnel de l'Islande obtenu par fermentation de chairs de certains requins, a une odeur très forte due à la transformation in fine de l’urée en ammoniac, comme vu pour les urines grâce à l’action de l’uréase. La chair du poisson passe alors d’un pH 6 à un pH 9.
- L’émanation de l’ammoniac gazeux a lieu également si on laisse vieillir trop longtemps certains fromages ou certains poissons et est associée de façon générale aux processus de putréfaction.
Pour en savoir plus sur la concentration des solutions vendues
Pour les étiquettes indiquant un pourcentage, il s’agit du pourcentage massique(xiii) correspondant au rapport entre la masse de la quantité d’ammoniac introduite(xiv) dans l’eau sur la masse totale de la solution obtenue. Donc l’information « solution à 13% » signifie que 100 g de solution contient 13 g de NH3.
Qu’est-ce que le degré Baumé ?
Il est étonnant de trouver encore une information en degré Baumé, unité exclue des unités légales françaises depuis 1961. À 20 °C, la correspondance entre la densité et les degrés Baumé (noté B) pour les liquides moins denses que l'eau (densité < 1) est : d = 140 / (B + 130). Cela donne pour la solution d’ammoniac à 22° d = 140/(22+130) = 0.921 et donc une masse volumique(xv) de 0,921 kg/L.
Les étiquettes au laboratoire de chimie
Dans les laboratoires de chimie l’étiquette indique un pourcentage massique, P, une masse volumique ρ en g par litre (g.L-1) et une masse molaire M en g par mole (g.mol-1). Ces 3 données permettent de déterminer la concentration molaire en ammoniac, [NH3,aq], exprimée en mol par litre (mol.L-1) ; la relation à utiliser est C = P* ρ /M où bien sûr la masse molaire de l’ammoniac est M = 17 g.mol-1 et non 35 g.mol-1, comme on le trouve de façon erronée sur certains flacons, sur des sites Internet grand public et même sur la fiche officielle associée à son numéro CAS(xvi) ! Cette masse molaire erronée provient de l’hypothèse fausse que l’ammoniaque aurait pour formule NH4OH(xvii).
Conclusion
Si l’ammoniac est connu depuis l’Antiquité par ses usages qui perdurent et satisfont les consommateurs, son identification ne date que de la fin du XVIIIe siècle et est due à Claude Louis Berthollet(xviii).
Et qu’en est-il des dénominations ammoniac ou ammoniaque et des formules chimiques NH3 ou NH4OH associées ? Cette chronique illustre que la chimie est une science étudiant des phénomènes complexes à modéliser dont l’interprétation ne fait pas nécessairement l’unanimité et évolue en fonction des connaissances.
Lydie Amann et Françoise Brénon et l’équipe question du mois
(i) du grec Ammoniakon, « de Ammôn », nom grec d'Amon, dieu égyptien, car on extrayait près du temple d’Ammon en Lybie un minerai nommé salmiac, qui libérait ce gaz. Le salmiac contient du chlorure d’ammonium NH4Cl.
(ii) Consulter Comment fabriquer des engrais avec de l'air ? La synthèse de l'ammoniac
(iii) Pour l’argenterie, le noircissement de l’argent étant lié à la formation de sulfure d’argent très stable, l’ammoniac ne suffit pas à le détruire par complexation. Pour en savoir plus : Nettoyer l’argenterie par « une recette de grand-mère » : comment ça marche ?
(iv) Pour en savoir plus Pourquoi ça frise ou ça défrise ?
(v) Ce calcul résulte de la valeur de la constante d’équilibre

On notera que 17 g de NH3 correspond à 1 mol d’ammoniac soit environ la dissolution de 25 L de gaz à température ambiante.
(vi) Voir la bonne définition du Larousse https://www.larousse.fr/dictionnaires/francais/ammoniaque/2936
(vii) On lira avec intérêt cet article du Chemical Education Why We Are all Using a Nonexistent Substance: NH4OH
(viii) L’acidité et la basicité d’une solution aqueuse sont mesurées sur une même échelle par le pH, grandeur reliée à la concentration en ions H+aq par pH = - log[H+aq].
Les concentrations en H+aq et OH-aq étant toujours liées par la relation [H+aq] * [OH-aq] = Cte. On considère qu’une solution est basique si son pH est supérieur à 7 et acide si pH <7.
(ix) En prenant le même exemple que précédemment (cf. note v), le pH de cette solution vaut 11,6.
(x) On peut consulter la fiche de toxicologie de l’ammoniac sur le site de l’INRS ici.
(xi) La réaction mise en jeu est : HCl (gaz) + NH3 (gaz) → NH4Cl (s). À ce sujet consulter l’anecdote historique La chimie contre les mauvaises odeurs.
(xii) La teneur en ammoniac dans l’air y est de l’ordre de 23 ppm (partie par million en volume dans l’air (mL/m3) d’après le CIGC - Comité Interprofessionnel de Gestion du Comté).

(xiv) Compte tenu de l’équilibre (A) très peu déplacé, la masse d’ammoniac introduite est quasiment égale à la masse de NH3(aq) à l’équilibre.
(xv) La masse volumique se calcule par la relation ρ = d*ρ(eau) sachant que ρ(eau) = 1 kg/L
(xvi) Le numéro CAS de la solution aqueuse est : 1336-21-6 et celui du gaz est 7664-41-7.
Il s’agit de son numéro d'enregistrement unique auprès de la banque de données de Chemical Abstracts Service.
(xvii) Exemple : Le chimiste dans son laboratoire prend une bouteille et étudie l’étiquette pour en connaitre les caractéristiques. Il lit par exemple : P = 28% ρ = 0,90 kg/L et M = 35,05 g/mol. Une autre bouteille donne les mêmes informations sauf au niveau de la masse molaire M = 17 g/mol.
Or, l’expression de la concentration molaire exprimée en mol /L a pour expression : C = P* ρ /M .
Ainsi, l’application numérique pour la bouteille 1 donne donc C voisine de 7,2 mol. L-1 et pour la bouteille 2 de 15 mol. L-1, le facteur 2 provenant du facteur 2 entre les 2 masses molaires. Pourtant les dosages acido-basiques de ces 2 solutions montrent que chacune des 2 bouteilles a une concentration en ammoniac NH3 voisine de 15 mol/L. L’erreur provient du fait que l’ammoniaque est assimilée à l’hydroxyde d’ammonium NH4OH en solution (d’où M = 14 + 16 + 5 = 35 g.mol-1) ce qui est erroné comme l’a montré l’étude de l’équilibre de dissolution dans lequel l’ammoniac reste essentiellement sous la forme NH3(aq).
(xviii) voir Berthollet et la découverte de la composition de l’ammoniac
Crédits illustration : DR. F. Brénon pour Mediachimie
Peut-être avez-vous été tenté, en vous croyant plus efficace, de mettre simultanément de l’eau de Javel et du détartrant dans la cuvette des WC afin de la désinfecter et de la rendre plus blanche.
Surtout ne faites pas cela ! Pour en être convaincu, découvrez la composition de ces produits et leurs rôles respectifs.
Le tartre ou calcaire
Ces deux termes sont synonymes. De formule chimique CaCO3, il s’agit du carbonate de calcium.
Le calcaire qui se dépose provient des eaux dites dures (car riches en ions calcium et magnésium mais aussi en ions bicarbonate (i)). En effet les eaux de pluie qui s’infiltrent, s’enrichissent en ions présents dans les couches géologiques traversées. Ainsi les régions calcaires vont conduire à des eaux dures dans les nappes phréatiques (ii).
La réaction de déposition du calcaire sur les canalisations et dans la cuvette des WC est la suivante :
Ca2+ + 2 HCO3- → CaCO3 (solide) + CO2 (gaz) + H2O
Le détartrant
Comme son nom l’indique il a pour rôle de retirer le tartre.
Or l’ion carbonate présent dans le calcaire est une base (composé capable de capter des ions H+ (iii) ) et le détartrant est un acide (composé capable de libérer des ions H+). Ils peuvent donc réagir l’un sur l’autre selon
CaCO3 + 2 H+aq → Ca2+ + CO2 (g) + H2O
Les bulles que vous observez sont donc des bulles de dioxyde de carbone et le dépôt de calcaire est éliminé. Le dégazage du dioxyde de carbone rend la réaction totale (iv).
L’acide présent dans un détartrant de WC varie selon les marques (v). On rencontre essentiellement des mélanges sous forme de gels ou poudres contenant de l’acide chlorhydrique, de formule HCl ou de l’acide phosphorique H3PO4 ou de l’acide sulfurique H2SO4. Sur une échelle de pH allant de 0 à 14 dans l’eau, la solution acide d’un détartrant pour WC a un pH proche de 1 ou 2 selon les produits. Le vinaigre ne convient pas (vi).
L’eau de javel
L’eau de Javel est une solution basique contenant aussi des ions hypochlorite ClO- et des ions chlorure Cl-.
La solution basique est due à de la soude ou hydroxyde de sodium NaOH dissoute dans l’eau. Ainsi l’eau de Javel a un pH voisin de 12 ou 13 selon sa concentration.
Quand vous utilisez l’eau de Javel vous recherchez à utiliser les propriétés des ions hypochlorite. En effet leur propriété essentielle est d’être un oxydant puissant ce qui a pour effet de détruire pratiquement tous les composés comme les virus, les bactéries et autres microorganismes ainsi que les produits issus de la décomposition de la matière organique. Les colorants et les odeurs disparaissent aussi.
Que se passe-t-il donc lors d’un mélange de détartrant et d’eau de Javel ?
L’acide du détartrant va consommer les ions hydroxyde de la soude présente dans l’eau de Javel selon la réaction, H+aq + OH- → H2O. Donc le pH va diminuer. Si on se retrouve en excès de détartrant le milieu devient acide et les ions hypochlorite deviennent alors instables en présence des ions chlorures.
Il se forme un dégagement de dichlore, gaz très dangereux pour la santé selon
ClO- + Cl- + 2 H+ → Cl2(g) + H2O
Alors n’hésitez pas à avertir vos connaissances et les enfants qu’il ne faut pas réaliser un tel mélange.
N’oubliez jamais de lire la notice des produits ménagers que vous utilisez. Dans le cas du détartrant il expressément écrit : « ATTENTION : Ne pas mélanger avec du chlore ou de la Javel ». Dans le cas de l’eau de Javel, l’information est la suivante : « Attention ! Ne pas utiliser en combinaison avec d'autres produits. Peut libérer des gaz dangereux (chlore) ».
La bonne marche à suivre
Dans un premier temps éliminer le calcaire en laissant agir le détartrant. Une fois le calcaire éliminé, rincer abondamment la cuvette en tirant successivement 2 à 3 chasses d’eau.
Puis ajouter de l’eau de Javel et laisser agir. Enfin, rincer abondamment.
Dans la mesure du possible aérez la pièce.
Et prenez toujours des précautions quand vous manipulez de l’eau de Javel : portez des lunettes et des gants de ménage.
Françoise Brénon et l’équipe question du mois
(i) Le bicarbonate a pour autre nom hydrogénocarbonate et pour formule chimique HCO3-. L’eau naturelle ayant un pH voisin de 6 à 7 les ions carbonate passent sous la forme hydrogénocarbonate, en raison de la stabilité de ces espèces en fonction du pH.

(ii) Les régions de France où l’eau est dure sont celles où les terres sont calcaires (Ile-de-France, Champagne crayeuse, Nord, Alpes…). Les régions où l’eau est douce c’est-à-dire qu’elles contiennent peu d’ions calcium et magnésium sont les régions de la Bretagne et du Massif Central…).
(iii) L’ion H+ est aussi appelé ion hydrogène. On le note pour simplifier H+aq, notation que l’on lit « ion hydrogène aqueux ».
(iv) Vous avez déjà rencontré cette réaction dans la question du mois : Pourquoi le champagne, le vin ou du Coca-Cola® peuvent-ils abimer le marbre ?
(v) Pour en savoir plus on peut consulter les fiches techniques des produits commerciaux en cherchant "fiche technique" + nom du produit sur un moteur de recherche.
(vi) Le vinaigre blanc contient de l’acide acétique (avec un pH voisin de 3,5) ce qui n’est pas assez efficace pour détartrer les WC. On l’utilise plutôt par exemple pour détartrer les cafetières. La composition des détartrants commerciaux tout prêts pour cafetières sont plutôt les acides citrique, lactique, sulfamique… (gamme de pH 2 à 4).
Crédits illustration : DR. Mediachimie
Le printemps est propice au bricolage et à l’embellissement des habitations. Portails, grilles de jardin, balustrades, garde-corps et autres objets en fer ou acier n’y échappent pas !
Votre pièce métallique extérieure s’est dégradée. Il faut avant tout traitement de prévention et de décoration éliminer la dernière couche de peinture souvent écaillée et cloquée et ôter la rouille par grattage et ponçage, éliminer toute trace de résidus puis dégraisser la surface avec un solvant organique (par exemple le white spirit(i) ou l’acétone(ii)) afin d’avoir un support net et sec.
Remettre alors une simple couche de peinture ne suffit pas si l’on veut augmenter la durée de vie du support.
Qu’est-ce que la rouille ?
Le fer est un métal qui se corrode en présence de l’oxygène de l’air et de l’humidité. La rouille qui se forme a une composition qui évolue au cours du temps et du taux d’humidité. Pour simplifier, on peut dire qu’elle est au final essentiellement formée de composés du fer à son degré oxydation III, FeO(OH) et Fe2O3 hydraté.
Cette couche d’oxydes en raison de sa structure à l’échelle microscopique n’adhère pas à la surface du fer, est perméable à l’air et l’humidité et forme des boursoufflures ; ainsi le métal peut continuer à s’oxyder.
Il est donc nécessaire de protéger le fer ou l’acier. Plusieurs étapes peuvent être nécessaires, successives ou simultanées.
Le décapage chimique = éliminer la rouille
La rouille peut être attaquée par les acides (entités libérant des ions H+)(iii). On ne peut pas utiliser n’importe quel acide à l’échelle du grand public. En effet par exemple il ne faut pas utiliser d’acide chlorhydrique ni sulfurique qui s’ils détruisent bien la couche de rouille attaquent aussi le fer en profondeur en dégageant du dihydrogène. En cas d’usage il est indispensable de se protéger les yeux par des lunettes de laboratoire et les mains avec des gants adaptés et d’effectuer un rinçage.
L’acide oxalique de formule HOOC-COOH est un décapant un peu plus facile à manipuler.
À l’issue d’une telle étape la surface du métal est mise à nu et il ne reste pas trace du produit décapant.
Produit chimique antirouille à la fois curatif et préventif
L’acide phosphorique H3PO4 en est le modèle type. Il peut être directement étalé au pinceau ou à la brosse sur la pièce à traiter. Si celle-ci est petite elle peut être totalement immergée dans cet acide.
Il y a à la fois destruction de la rouille et modification de l’acier à sa surface. En effet, une fois la rouille attaquée par l’acidité de l’acide phosphorique les ions Fe2+ et Fe3+, apparus à la surface de l’acier, se combinent aux ions phosphate pour former des phosphates de fer solides(iv) qui, de par leurs structures, adhèrent à la surface du fer, protégeant ainsi la surface sous-jacente d’une attaque ultérieure par l’oxygène et l’eau et contribuent de fait à diminuer la vitesse de corrosion. On parle de passivation du fer ou d’inhibition à la corrosion ou encore de couche anticorrosion.
Les acides carboxyliques, de formule générique RCOOH, avec un groupe R à longue chaine carbonée (8 à 10 atomes de C par exemple) peuvent jouer le même rôle. On parle d’acide gras. L’ion carboxylate formé RCOO- se combine aussi aux ions Fe3+ pour créer une fine couche protectrice de passivation(v).
Couche d’apprêt
L’apprêt est une couche de peinture primaire destinée à améliorer l'adhérence, l'efficacité de la protection anticorrosion ou à limiter les irrégularités de surface. Une fois étalé, cet apprêt reste sur la pièce traitée. C’est par exemple le cas du produit Rustol ©(vi) « vernis solvanté qui forme un film protecteur » isolant le métal du milieu extérieur.
Les peintures contiennent les pigments(viii) pour répondre à la couleur demandée incorporé à un mélange, à base de résines polymères qui formeront un film après étalement et séchage du solvant. En plus du côté esthétique, ce film joue un rôle d’étanchéité.
Le résines polymères pour peintures métalliques sont à base de composés glycérophtaliques aussi appelés alkydes ou de polyuréthannes(ix). Il existe aussi des résines dites « alkyd-uréthanes »(x). Ces peintures se trouvent soit en phase solvant organique (white spirit) soit aussi depuis les années 2000 pour certaines sous forme d’émulsion en phase aqueuse.
La peinture antirouille « tout-en-un »
Pour simplifier le travail du bricoleur et des professionnels et éviter de déposer d’une part une ou deux couches d’antirouille suivies de la peinture de finition, certaines peintures actuelles pour le fer contiennent à la fois les pigments et les composants antirouille, le tout incorporé au mélange de résines polymères décrites ci-dessus.
Les produits antirouille passivant intégrés au sein de ces peintures, sont pour la plupart à base de dérivés de l’acide phosphorique comme les phosphates de zinc ou d’ammonium(xi). On peut aussi trouver des carboxylates de sodium.
Des progrès considérables dans ces formulations de peinture permettent d’avoir une efficacité de plusieurs années.
Toutefois il faut éviter de rayer ou d’écailler la surface ou de poser longtemps un autre objet métallique comme des supports de jardinière métallique(xii) pour balustrade de balcon. Les déjections d’oiseaux sont aussi une cause de dégradation des peintures.
Si vous achetez une grille de jardin galvanisée, c’est-à-dire que l’objet en fer a été intégralement recouvert d’une fine couche de zinc en usine, sa durée de vie est beaucoup plus grande. Il s’agit là d’un autre mode de protection du fer(xiii). Dans ce cas le métal au contact avec l’extérieur n’est plus du fer mais du zinc. Pour le peindre il faut préalablement étaler ou pulvériser une couche primaire pour acier galvanisé à base de résine époxy pour faciliter l’accrochage de la peinture de finition.
Allez, bon courage et maintenant à vos pinceaux et rouleaux !
Françoise Brénon et l’équipe question du mois

Ballustrade avec rouille. Photo : F. Brénon
(i) Le white spirit est un mélange d’hydrocarbures contenant 8 à 12 atomes de carbone et sans benzène. À l’échelle industrielle le dégraissage des métaux se fait de plus en plus à la vapeur d’eau sèche pour limiter le rejet de vapeurs organiques issues des solvants (COV).
(ii) L’acétone a pour formule H3CCOCH3
(iii) selon par exemple : Fe2O3 + 6H+ = 2 Fe3+ + 3 H2O
(iv) Le phosphate formé en surface avec les ions ferriques est par exemple FePO4, selon la réaction Fe2O3 + 2 H3PO4 → 2 FePO4 + 3 H2O et avec les ions ferreux Fe3(PO4)2, 8 H2O source Techniques de l’Ingénieur § 1.2.2.3. « Traitements de surface des métaux avant peinture. Procédés » Théophile Guéguen (1992)
(v) Selon les conclusions de la thèse (page 167) de Stéphanie Hollner, sur le « Développement de nouveaux traitements de protection à base d’acide carboxylique pour la conservation d’objets en fer du patrimoine culturel » il est établi que « dans le cas des solutions à base d’acide décanoïque ou de décanoate de sodium, le carboxylate de fer formé est constitué par des agrégats de type Fe3O dans l’entité chimique [Fe3O(CnH2n+1COO)6 (H2O)3]+, NO3- , xH2O avec n = 10 »
(vi) La fiche technique du Rustol© est ici (site du fabricant https://www.owatrol.com)
(vii) Pour en savoir plus consultez le Zoom sur les pigments de J.-P. Foulon, Mediachimie.org
(viii) Le film thermodurcissable tridimensionnel résulte de la réaction de polymérisation entre du glycérol  et de l’anhydride phtalique
et de l’anhydride phtalique  .
.
(ix) Les polyuréthannes découlent d’une réaction entre un diol (HO-R-OH) et un diisocyanate (OCN-R'-NCO) pour conduire à un polymère de motif répétitif → -(OCONH- R'-NHCOO-R)- . Les chaînes R et R’ peuvent être insaturées permettant une réticulation conduisant à un composé également tridimensionnel. Ces peintures sont parfois vendues sous forme de 2 composants à mélanger avant usage.
(x) Il s'agit d'alkydes modifiés dans lesquels une partie de l'anhydride phtalique est remplacée par un isocyanate tel que le diisocyanate de toluène (TDI). Ils sèchent généralement plus rapidement et présentent une résistance à l'abrasion et une résistance à l'hydrolyse améliorées, mais sont plus chers.
(xi) Phosphate de zinc de formule Zn3(PO4)2 et phosphate d’ammonium de formule (NH4)3PO4. Avec le phosphate de zinc, Il peut se former à la surface du fer des phosphates mixtes de zinc et de fer II passivants.
(xii) Dans ce cas on observe des créations de micro-piles, le fer étant attaqué en certains endroits et parfaitement sain en d’autres.
(xiii) Pour en savoir plus, vous pouvez consulter la partie B de la ressource Corrosion des métaux et protection, David Soissons, Dossier pédagogique Nathan / Mediachimie.org
Les fêtes arrivent et vous allez peut-être nonchalamment poser votre verre de vin, de champagne ou de Coca-Cola® sur le plateau de marbre qui recouvre un ancien meuble chez vos parents ou grands-parents.
Aïe aïe aïe ! Un anneau rugueux et parfois blanchâtre risque d’apparaitre quand vous allez retirer votre verre si quelques gouttes du précieux liquide ont coulé le long du verre jusqu’à son pied. Mais que s’est-il passé ?
Des boissons légèrement acides
Les vins qu’ils soient blancs ou rouges sont légèrement acides. En effet ils contiennent entre autres les acides tartrique, malique, citrique, lactique et succinique. Les trois premiers proviennent du moût et les deux derniers des fermentations. Le pH est la grandeur qui mesure cette acidité (i). En moyenne il vaut environ 3,3 pour un vin blanc, 3,5 pour un rouge, 3,4 pour un rosé et 3,0 pour un champagne. Quant au Coca-Cola® qui contient de l’acide phosphorique, son pH est voisin de 2,5 pour le classique (ii). De même les jus de fruits comme les jus d’orange ou de citron sont acides. Les boissons gazeuses contiennent de plus une forte concentration en dioxyde de carbone CO2.
Et le marbre, de quoi est-il fait ?
Nous parlons ici du vrai marbre. Le calcaire ou carbonate de calcium (CaCO3) est le principal constituant des marbres. S’ils sont colorés, veinés, ou polychromes comme peut être celui du plateau de votre meuble c’est grâce à la présence d’autres éléments chimiques (iii). Selon les carrières d’où provient le marbre ces éléments sont caractéristiques et font sa renommée, comme le marbre blanc veiné de gris de Carrare ou le rose des carrières de Caunes-Minervois que l’on peut admirer au Grand Trianon dans le parc du château de Versailles…
Quelles réactions avec le marbre ? Il faut distinguer les boissons tranquilles des boissons gazeuses.
Pour les vins et jus de fruits non gazeux
Le calcaire est une base et si un acide l’attaque, il se passe une réaction qui s’accompagne d’un dégagement de dioxyde de carbone. Cela dégrade le calcaire en surface. Appelons RCOOH tout acide présent et la réaction s’écrit :
2 RCOOH + CaCO3 → 2 RCOO- + Ca2+ + CO2 (gaz°) + H2O
Quand vous retirez votre verre, un petit rond creux apparait et la surface du marbre y est devenue un peu rugueuse. La dégradation locale est irréversible. Pour redonner un bel aspect il faudrait repolir le marbre.
Pour le champagne et les boissons au cola, c’est plus compliqué !
Ces deux boissons présentent de plus du dioxyde de carbone dissous. Pour le champagne il s’est formé in situ lors de la fermentation alcoolique en milieu clos (iv). Pour le cola il est ajouté sous pression. À la réaction acido-basique précédente se superposent d’une part une attaque par l’acide phosphorique dans le cas du cola et pour les deux une suite de réactions liées à la forte présence de CO2 dissous.
CaCO3 (contenu dans le marbre) + CO2 (dans la boisson) + H2O → 2 HCO3- + Ca2+
Des ions bicarbonate (HCO3-) (v) et des ions calcium (Ca2+) sont dissous dans l’eau de la boisson et présents à la surface du marbre. Si on laisse s’évaporer l’eau il se forme un dépôt complémentaire. Du carbonate de calcium blanc se reforme avec dégagement de CO2 selon :
2 HCO3- + Ca2+ → CaCO3(s) (dépôt à la surface du marbre) + CO2 + H2O
Mais les conditions de cristallisation de ce carbonate ne sont plus les mêmes que celles géologiques qui ont conduit aux cristaux de calcite du marbre. La trace blanche qui apparait est ainsi du calcaire pulvérulent déposé sur le marbre !
C’est pourquoi il est déconseillé de réaliser un plan de travail en vrai marbre dans une cuisine car le risque de déposer un liquide (vinaigre, vin…) ou un aliment acide (citron, agrume…) est très important. Les plans de travail d’aspect pierre et résistants sont plutôt en granit ou en matériaux de synthèse capable de parfaitement imiter le marbre ! Il existe aussi des « plans de travail mélaminés » : sur le support en bois aggloméré on encolle une feuille décorative imitant le marbre blanc veiné ou de carrare et enduite d'une couche de résine mélamine (vi) polymère thermodurcissable très résistant.
Toutefois des plans de travail en marbre pour cuisine ou coin repas existent et sont traités en surface par imprégnation afin de boucher les pores et laisser en surface une couche hydrophobe à base de silicones. Il est nécessaire de les entretenir, les nourrir et les protéger par des produits adaptés (cire translucide…).
Certains lavabos ou vasques de salle de bain sont en vrai marbre. Le risque est plus faible d’y renverser un liquide acide, mais pensez-y !
Françoise Brénon et l’équipe Question du mois
(i) Le pH dans l’eau varie de 0 à 14. Le milieu est neutre quand le pH vaut 7. Il est acide si pH < 7 et basique si pH > 7.

(ii) À combien s'élève le pH du Coca‑Cola et qu'est-ce que cela veut dire? sur le site Coca-Cola Suisse
(iii) Le calcaire y est présent sous forme de cristaux de calcite, CaCO3, pouvant présenter des structures différentes avec des traces d’autres ions minéraux (manganèse Mn, fer Fe, zinc Zn…).
(iv) Ce sont presque 5 litres de CO2 qui sont piégés dans une bouteille standard créant une pression d’environ 5 à 6 bar. Attention donc de ne pas prendre le bouchon dans les yeux quand il saute ! Pour en savoir plus : Pourquoi y-a-t-il des bulles dans mon champagne ?
(v) L’ion HCO3- a pour nom hydrogénocarbonate mais il est plus connu dans le grand public sous le nom de bicarbonate.
(vi) Le monomère mélamine a pour formule C3H6N6

Pour en savoir plus
Carbonate de calcium / calcite/ calcaire, Produit du jour de la SCF
Zoom sur la vinification, Mediachimie.org
Mesurer le pH d’une solution : des acides, du raisin au vin, dossier Nathan Mediachimie, Mediachimie.org
Crédits illlustration : Tache sur marbre. Source : Françoise Brénon
Les bonbons et dragées se font une part belle dans le monde des sucreries, et au premier regard, leurs couleurs nous incitent à les goûter.
Nous connaissons tous ces petits personnages bleus de BD, logeant dans un village champignon et aussi déclinés en bonbons ! Mais comment les colorer en bleu ?
Caractéristiques physico-chimiques nécessaires pour être un colorant utilisable dans un bonbon
Le bonbon est par exemple constitué d’une solution aqueuse à laquelle on ajoute un colorant alimentaire, du sucre et de la gélatine à chaud. Les molécules colorées susceptibles d’être utilisées doivent pouvoir se disperser de façon uniforme au sein de la gélatine, résister aux différents traitements lors de la fabrication du bonbon et sur le long terme résister à la lumière et à l’oxygène de l’air.
Qu’en est-il du bleu patenté V ? (1)
Le bleu patenté V (i), au nom de code E 131, est un colorant alimentaire de synthèse, soluble dans l’eau. Il donne un bleu vif et répond à toutes les caractéristiques nécessaires précédemment citées. Il est ou a été le colorant bleu de nombreux bonbons et autres aliments et boissons. Mais Il est soupçonné d’un potentiel allergène. Son utilisation est réglementée en Europe et sa dose journalière admissible (DJA) a été diminuée en 2013 à 5mg/kg de masse corporelle (ii) par l'Autorité européenne de sécurité des aliments (EFSA).
Compte tenu que les enfants sont les principaux consommateurs de bonbons et que la demande du public vers des produits d’origine naturelle est forte, certains fabricants ont cherché à remplacer ce colorant par un autre issu d’une ressource naturelle, ce qui est effectif depuis 2020 pour les petites créatures bleues !
Le bleu dans les plantes sauvages
Même si bleuet, jacinthe des bois, myosotis, mûres et myrtilles …nous évoquent la couleur bleue, la nature nous offre très peu cette couleur parmi les plantes sauvages. Et si on arrive à en extraire les molécules responsables de leur couleur encore faut-il qu’elles répondent aux caractéristiques nécessaires à leur utilisation et que la matière première soit abondante. On comprend bien alors que ces plantes ne vont pas répondre à la demande.
La spiruline
La recherche a été longue pour trouver un composé naturel fournissant un bleu stable, répondant à tous les critères y compris l’innocuité et dont la production puisse être notable. La spiruline alimentaire s’est avérée le bon candidat. La spiruline est un ensemble de cyanobactéries (iii) alimentaires procaryotes (iv) qui se reproduisent dans des eaux chaudes (35 à 40°C) peu profondes et saumâtres (on parle aussi de microalgues) (v). Il existe plusieurs types de souches de bactéries et selon les zones géographiques (vi) et les conditions de production, la composition chimique varie (2). Toutefois en résumé les spirulines sont avant tout très riches en protéines. Elles contiennent également des glucides, un peu de lipides, des vitamines, des sels minéraux et des pigments. Ces différents constituants sont indépendamment recherchés pour des applications diverses (santé, alimentation, pigments, aquaculture, cosmétique…).
La couleur bleue issue de la spiruline
La spiruline contient d’une part des pigments verts (chlorophylles) et oranges (bêta-carotènes) et parmi les protéines qui la constituent il y a des phycocyanines qui possèdent un groupe chromophore bleu fixé à la chaine protéïque.
Les bêta-carotènes s’oxydent à l’air, les chlorophylles se dégradent à la lumière. Par contre les phycocyanines sont d’une part des anti-oxydants et d’autre part plus résistantes à la photo-destruction. Ainsi la spiruline séchée et longtemps exposée à l’oxygène de l’air et à la lumière, devient bleutée. Les phycocyanines représentent 12 à 17 % en masse (selon la souche) de la spiruline séchée.
La spiruline la plus utilisée est celle issue de microorganismes Arthrospira platensis. On en extrait (vii) tout particulièrement la C-phycocyanine qui, purifiée, concentrée et séchée, donne une poudre bleue, utilisée comme colorant alimentaire.
La C-phycocyanine peut très schématiquement être représentée selon
Chaine protéinique (viii)― groupe chromophore bleu

La structure de son groupe chromophore est représentée ci-contre (source https://www.rcsb.org/ligand/CYC)
La C-phycocyanine a été autorisée en 2013 par la FDA comme colorant alimentaire des gommes et bonbons et est en 2020 le seul colorant bleu naturel autorisé aux USA, Europe et Chine dans des applications alimentaires telles que les pâtisseries (glaçage, nappage…) laitages, gélatines, céréales…, des applications pharmaceutiques (enrobages de produits) et cosmétiques.
La phycocyanine est aussi très recherchée pour son pouvoir anti-oxydant.
Alors bonne dégustation, mais attention au sucre !
Françoise Brénon
(i) Le bleu patenté est utilisé sous forme de sel de calcium Ca(C27H31N2O7S2)2 ou de sodium Na(C27H31N2O7S2).
Sa formule développée est page 8 https://efsa.onlinelibrary.wiley.com/doi/pdf/10.2903/j.efsa.2013.3108
(ii) Source Avis scientifique sur la réévaluation du brevet Blue V (E 131) en tant qu’additif alimentaire EFSA Journal (2013)
(iii) Les cyanobactéries (cyano du grec ancien kyanos signifiant bleu) sont des bactéries qui synthétisent leurs molécules organiques comme les plantes, par photosynthèse. Afin de capter la lumière, elles utilisent des pigments présents dans leurs structures.
(iv)Un procaryote est un microorganisme unicellulaire dont la structure cellulaire ne comporte pas de noyau.
(v) Elles ont une configuration spatiale en forme d’hélice d’où le nom spiruline dérivant du latin spira (enroulement).
(vi) En 2018 la production mondiale provient de Chine à plus de 50 % (2). Parmi les autres pays producteurs, citons les USA (Hawaï), le Mexique, la Thaïlande… La France en produit en très petits tonnages.
(vii) Plusieurs procédés d’extraction sont possibles (2) et (3). Après une destruction de la membrane de la bactérie (désintégration cellulaire) tout en évitant la dénaturation des protéines, il faut séparer les protéines solubles dans l’eau, ce qui est le cas des phycocyanines, des autres protéines liposolubles et des lipides. Pour ceux-ci on essaie d’éviter des solvants organiques à impact environnemental. L’extraction à l’aide de CO2 supercritique répond par exemple à ce critère.
(viii) La structure de sa chaine protéïque est répertoriée sur le site PDB (Protein Data Bank) RCSB PDB - 1GH0: STRUCTURE CRISTALLINE DE LA C-PHYCOCYANINE DE SPIRULINE PLATENSIS
Pour en savoir plus
(1) Couleur et coloration des aliments, une simple affaire de chimie ? de Sylvain Guyot, La chimie et l’alimentation (EDP Sciences)
(2) Spiruline : Culture, production et applications, document très complet sur le sujet par Maryline Aber Vian, Techniques de l’Ingénieur publié le 10/03/2021
(3) Évaluation des méthodes d’extraction de la phycocyanine et son rendement à partir de spirulina platensis de Imène Lafri et coll., Agrobiologia
On trouve toutes sortes de recettes dites « de grand-mère » sur Internet pour nettoyer son argenterie. Dans ces dites recettes il est même précisé « sans utiliser de produit chimique » !!! Est-ce vrai ?
D’où provient le noircissement de l’argent ?
Les aliments contiennent naturellement des sulfures comme l’albumine du blanc d’œuf, la cystéine présente dans les protéines, des sulfures organiques dans les choux, les oignons, certaines boissons…
Dans l’air il peut y avoir des traces de sulfure d’hydrogène (H2S, reconnaissable à son odeur « d’œuf pourri » !) et de sulfure de diméthyle (H3C-S-CH3) qui est le plus abondant des composés biologiques contenant du soufre émis dans l'atmosphère.
C’est ainsi la présence de ces sulfures qui sont majoritairement responsables de la formation de dépôts noirâtres à la surface d’un objet en argent. L’argent a été oxydé par le dioxygène de l’air et en présence de ces sulfures s’est recouvert de sulfure d’argent Ag2S, noir, très stable (1).
« Faire l’argenterie » consiste donc à éliminer ce sulfure d’argent.
Une recette : « Nettoyer son argenterie dans un bain de sel ».
Élucidons cette « recette de grand-mère » dont le titre interpelle le chimiste ! En effet ce titre est trompeur ! Ce n’est pas le sel qui nettoie l’argenterie.
Regardons de plus près la recette. Prendre une feuille d’aluminium. La disposer dans une cuvette en plastique (éviter un autre métal). Mettre une poignée de gros sel dans une casserole d’eau que l’on porte à ébullition. Puis verser cette eau salée chaude dans la cuvette. Introduire délicatement (sans se brûler) l’objet en argent à nettoyer et le poser au contact de la feuille d’aluminium. Laisser agir plusieurs minutes à 1 heure selon l’état d’oxydation de l’argent. Il est précisé que si l’objet en argent est très noir, on peut l’envelopper avec la feuille d’aluminium pour plus d’efficacité. Il est aussi dit que l’on peut ajouter du bicarbonate. Rincez puis séchez avec un chiffon très doux.
Notons que cette recette fonctionne bien.
Alors quels rôles jouent ces différents ingrédients ?
Le composé essentiel à la réussite de l’opération est ici l’aluminium. C’est un métal très réducteur. Il attaque le sulfure d’argent qui était un état oxydé de l’argent. L’argent est régénéré. Une partie de l’aluminium s’oxyde en ions Al3+. Compte tenu du pH de la solution ces ions précipitent sous forme d’hydroxyde d’aluminium, à la surface de l’aluminium qui se ternit.
La réaction (2) mise en jeu est
3 Ag2S + 2 Al +6 H2O → 6 Ag + 2 Al(OH)3 + 3H2S
On est en présence d’une pile (3), la pièce en argent étant au contact de la feuille d’aluminium. Si l’on enveloppe la pièce en argent par l’aluminium le contact entre les 2 métaux est meilleur facilitant ainsi les échanges d’électrons entre l’aluminium et le sulfure d’argent déposé sur l’objet en argent.
Quel est le rôle du sel ? Le sel est du chlorure de sodium (NaCl) qui se dissout sous forme d’ions sodium (Na+) et chlorure (Cl-). Il favorise les transports des ions (4) en solution mais n’intervient pas dans le bilan chimique.
La chaleur a pour but d’accélérer la réaction.
H2S : si vous avez déjà fait l’expérience, vous avez constaté l’émanation d’une mauvaise odeur. Elle est due à la formation du sulfure d’hydrogène produit durant la réaction et dont le dégazage est favorisé par la chaleur.
L’ajout éventuel du bicarbonate de sodium permet de stabiliser le pH vers 8,3 ce qui limite le dégazage de H2S.
Précautions
- Prenez soin de ne pas traiter de la même façon un bijou en argent avec des pierres fines incrustées. Ce mode opératoire ne concerne que des objets et bijoux en argent massif ou des couverts argentés (5).
- D’autres recettes proposent d’ajouter du vinaigre et non du bicarbonate. C’est à éviter car cela favorise la formation de H2S.
- Dans tous les cas aérer la pièce lors de ces manipulations.
Autres méthodes
- Frotter avec du carbonate de calcium ou avec une pâte de bicarbonate et de gros sel à confectionner soi-même. Il s’agit alors seulement de frotter et d’abraser la surface pour éliminer les traces de sulfures d’argent. Cela ne peut convenir qu’à des objets peu noircis et ne permet pas d’éliminer les traces restantes de sulfure d’argent piégés dans les micropores de la surface de l’objet.
Outre la faible efficacité, les risques sont de rayer l’argent qui est un métal assez mou et qui gardera les traces de ces rayures bien que les grains de bicarbonate et de gros sel soient estimés comme pas trop durs. De manière générale il vaut mieux éviter de frotter les objets en argent.
- Frotter avec une brosse à dent trempée préalablement dans du jus de citron : toujours abraser avec risque de rayures et de toute façon le citron n’est pas un acide capable de dissoudre Ag2S.
- Les professionnels de la restauration des objets d’art, de la bijouterie et des restaurants utilisant des couverts en argent pour leurs clients sont amenés à entretenir très souvent l’argenterie. Ils utilisent des produits à action très rapide dans lesquels ils les trempent. Le principe actif est alors la thio-urée qui réagit sur le sulfure d’argent l’éliminant ainsi de la surface de l’argent (6). Un rinçage soigneux termine l’opération. Il est indispensable de manipuler ces produits avec des gants et de porter des lunettes afin d’éviter tout contact avec la peau et les yeux.
Françoise Brénon et l’équipe question du mois
(1) En présence de sulfure d’hydrogène et d’oxygène de l’air, le sulfure d’argent noir, très stable, se forme selon
4 Ag + 2 H2S + O2 →2 Ag2S + 2 H2O
(2) Cette réaction est très favorable car sa constante d’équilibre vaut 10140 >>1
Les données nécessaires à ce calcul, E° (Ag+ / Ag) = 0,80 V ; E° (Al3+ / Al) = - 1,66 V ; pKs (Ag2S) = 49,2 ; pKs (Al(OH)3) = 33 ;
H2S : pKa,1 = 7,05, pKa,2 = 12,9 ; pKe = 14, sont issues de Les réactions chimiques en solution de G. Charlot (Masson).
(3) L’aluminium est le pôle négatif, c’est l’anode où se passe l’oxydation :
Al + 3 H2O → Al(OH)3 + 3 H+ + 3e-
Le pôle positif est constitué du sulfure d’argent déposé sur l’argent. Il s’y passe la réduction :
Ag2S + 2 H+ + 2e- → 2Ag + H2S
(4) Le sel dissout joue ici le rôle de l’électrolyte de la pile.
(5) Les couverts dit « en argent » sont rarement en argent massif. Ils sont en général en cuivre ou alliage de cuivre sur lequel a été déposé une fine couche d’argent.
(6) La thio-urée, notée de façon simplifiée Tu, a pour formule H2N-CS-NH2.
Si le mode opératoire est utilisé depuis le milieu du 20e siècle, la réaction mise en jeu suscite encore des questions. D’après les publications les plus récentes il est proposé 3 types d’interprétation :
- Soit une complexation (écrite ici en milieu acide) mettant en jeu la formation d’un complexe mononucléaire de Ag(I) selon
Ag2S + 2H+ + 2n Tu → 2 AgTun+ + H2S, n pouvant aller de 1 à 4. - Soit la formation d’un complexe binucléaire de l’Ag(I) selon
Ag2S + 2H+ + n Tu → Ag2Tun2+ + H2S, n allant de de 1 à 6 avec une forte présomption pour la forme majoritaire Ag2Tu42+. - Soit enfin la formation d’un composé éliminant Ag2S de la surface de l’argent selon
Ag2S + 2 CS(NH2)2 → 2 Ag-S-S-C(NH2)2
Sources :
- Métallurgie de l’argent § 6.2.1. in Les Techniques de l’Ingénieur (2006) et Silver and Acid-thiourea Silver Dips: Rinsing and Aging Monitored by Electrochemistry, L.Selwyn et W. R. McKinnon, Studies in Conservation (2021) 66:2, 98-112
- Potentiometric study of silver complexes with thiourea in acid media, P. Lukinskas et al. , Journal of Coordination Chemistry (2008) 61:16, 2528-2535
- Reaction of Thiourea With Silver Sulfide Tarnish Layers On Silver Surfaces, Ariga Allehyari (Californie State University, 2020)
Hum ! Un beau gâteau bien gonflé ! Les recettes des cakes, quatre-quarts, madeleines, cookies… nécessitent de la levure dite « chimique ». De quoi s’agit-il et à quoi sert-elle ?
Tout d’abord le mot « levure chimique » est utilisé pour se différencier de la « levure de boulanger » dont l’action est due à des microorganismes.
Pourquoi ajouter de la levure chimique ?
L’objectif de la levure chimique est de libérer un gaz lors de la cuisson afin de faire gonfler la pâte du gâteau. C’est ainsi que ces sachets sont aussi surnommés « poudre à lever » ou « poudre levante ». Dans la pratique ce gaz est le dioxyde de carbone (ou gaz carbonique), CO2. Il est obtenu par une réaction acidobasique une fois que la levure est mélangée aux ingrédients et humidifiée.
Que contiennent les sachets de levure chimique ?
Citons quelques compositions indiquées. Vous reconnaitrez sans doute celle que vous avez achetée :
- diphosphate disodique, carbonate acide de sodium, amidon de blé ;
- pyrophosphate disodique, bicarbonate de sodium, amidon de blé ;
- diphosphate disodique, bicarbonate de soude, amidon de maïs ;
- diphosphtates et carbonates de sodium, farine de blé ;
- pyrophosphate de sodium, bicarbonate de sodium, farine de froment (ancienne formule) ;
- acide tartrique, bicarbonate de soude, fécule de maïs (ancienne formule) ;
- crème de tartre, carbonate acide de sodium, fécule (ancienne formule).
À première vue ces compositions semblent différentes. Regardons de plus près.
Le bicarbonate de sodium, le carbonate acide de sodium et le bicarbonate de soude sont en réalité le même composé chimique dont le nom précis est l’hydrogénocarbonate de sodium et qui a pour formule chimique NaHCO3 (ou Na+, HCO3-) (i). C’est l’ingrédient commun indispensable. C’est lui qui permettra de libérer le dioxyde de carbone en jouant un rôle de base.
Les termes diphosphate disodique et pyrophosphate disodique concernent le même composé de formule Na2H2P2O7 (ii). L’acide tartrique a pour formule C4H6O6 (iii) et la crème de tartre KC4H5O6. Ce sont tous les trois des composés au comportement acide en présence d’eau.
La farine de froment, l’amidon de blé ou la fécule ou l’amidon de maïs contiennent tous de l’amidon [1]. Il est nécessaire à la conservation ou stabilisation du produit avant usage en limitant la réaction chimique entre les deux autres constituants et en absorbant l’humidité. Il est donc très important que le sachet soit conservé au sec.
Lors de la réalisation de la recette, il est aussi nécessaire de mélanger à sec la levure à la farine avant l’ajout des ingrédients humides.
L’ajout d’eau
Quelle que soit la recette, l’ajout d’eau est indispensable. Elle est apportée soit avec les œufs (l’eau représente 75% de la masse d’un œuf), soit avec un jus de fruit, du lait, ou tout simplement de l’eau seule…) . Elle dissout les acides et les bases contenus dans la levure, facilite le malaxage des ingrédients et la mise en contact des réactifs.
Le gonflement : quelles réactions ?
Une réaction entre acide et base
Une fois tous les ingrédients de la recette bien mélangés, les acides présents échangent un proton H+ avec le bicarbonate selon, par exemple :
H2P2O72- + HCO3- → CO2 (gaz) + H2O + HP2O73-
Cette réaction commence faiblement dès le mélange à froid puis à la chaleur du four, le dégagement de CO2 s’accentue et s’accélère.
En effet cette réaction est équilibrée avec une constante d’équilibre proche de 1. Le chauffage est favorable au dégazage de CO2 ce qui déplace l'équilibre jusqu’à la consommation totale du bicarbonate. Ainsi la pâte lève ; il se crée des alvéoles. Puis la pâte alvéolée se solidifie en gardant sa forme. Voilà c’est réussi !
Le composé secondaire formé HP2O73- est à la fois un acide et une base et seul dilué donnerait un pH voisin 7,3, soit un pH quasiment neutre. S’il reste du réactif initial H2P2O72- le pH serait alors légèrement inférieur à 7.
Pourrait-on utiliser du bicarbonate seul ?
C’est envisageable car il participe à l’équilibre 2 HCO3- = CO2 (gaz) + CO32- + H2O qui montre une formation possible de dioxyde de carbone et de carbonate. Toutefois le dégagement est quasi nul à froid, l’équilibre étant en faveur de HCO3- et ne se fait que lentement et de façon moindre à partir de 70 °C.
Le gâteau peut se solidifier avant que la pâte soit totalement levée. De plus l’ion carbonate CO32- formé en parallèle donne un milieu très basique au goût peu agréable.
Et le jus de citron ?
Quand l’eau est ajoutée sous forme de jus de citron (cake au citron, par exemple) cela introduit de l’acide citrique (iv) qui participe notablement à l’augmentation du dégazage. Il n’est en général pas totalement consommé ce qui donne ce petit goût acide caractéristique de cette pâtisserie. Mais ce n’est pas son seul rôle : il influence le caractère viscoélastique de la pâte à base de farine.
Que faire si on est en panne de levure chimique ?
Vous pouvez utiliser du bicarbonate de sodium et ajouter un peu de jus de citron.
Effervescence et analogie
On peut noter que toutes sortes de produits effervescents (dont des médicaments) présentent les mélanges bicarbonate et acide citrique ou bicarbonate et dihydrogénophosphate donnant du CO2 dès l’ajout d’eau.
Historiquement
Aux États Unis, c’est dans les années 1840 qu’apparait dans un livre de cuisine la proposition d’ajouter aux ingrédients d’une pâte de gâteau du bicarbonate de sodium et de la crème de tartre. Puis de nombreux essais ont été réalisés, y compris en Europe, pour sélectionner l’acide à ajouter avec le bicarbonate, la source d’amidon et les bonnes proportions. Les industriels ont alors vendu des mélanges prêts à l’emploi, aux proportions jalousement gardées.
Et le bicarbonate de sodium, matière première indispensable
Composé connu depuis l’Antiquité à l’état naturel, c’est le Français N. Leblanc qui a mis au point le premier procédé de fabrication à la fin du XVIIIe siècle [2], plus tard supplanté par le procédé Solvay [3]. Le premier producteur mondial est encore Solvay. Il existe des gisements naturels conséquents de bicarbonate aux États-Unis.
Le bicarbonate a de très nombreuses autres applications [3] [4].
Allez, à vos recettes !
Et n’oubliez pas de bien respecter les proportions. Les sachets vendus contiennent en général 10 g de levure à mélanger dans 500 g de farine. Un défaut de levure et le gâteau n’est pas levé, un excès de levure et le gâteau ne lèvera pas plus mais aura au final un arrière-gout de levure.
Françoise Brénon
(i) Cet additif alimentaire a pour code E500. Il est appelé baking soda dans les recettes américaines. Dans une des compositions lues sur les sachets, le terme « carbonates » avec un s (donc pluriel) est imprécis et fait penser à un mélange de carbonate ( CO32-) et d’hydrogénocarbonate. Ces composés appartiennent aux couples acides-bases CO2, H2O / HCO3- / CO32- dont les pKa sont 6,35 et 10,3 et jouent un rôle similaire.
(ii) Il s’agit du dihydrogénopyrophosphate disodique, codé E450i.
Le nom pyrophosphate de sodium indiqué sur un des sachets est imprécis. On pourrait penser à Na4P2O7 dont le nom précis est pyrophosphate tétrasodique. Mais celui-ci est une base ne pouvant donc réagir avec le bicarbonate pour donner du CO2. En réalité à l’analyse le produit contient aussi le E450i, soit H2P2O72-, comme dans les autres sachets. Les couples acidobasiques relatifs à l’acide pyrophosphorique sont : H4P2O7 / H2P2O7- / H2P2O72- / HP2O73- / P2O74- et les pKa correspondants sont 1,0; 2,5 ; 6,1 ; 8,5 (source « Les Réactions chimiques en solution », G. Charlot, chez Masson)
(iii) Ce diacide de formule semi-développée HOOC-CHOH-CHOH-COOH a pour nom précis l’acide 2,3-dihydroxybutanedioïque dont les pKa sont 3,0 et 4,4. Son code est le E334.
KC4H5O6 correspond au monoacide K+, -OOC-CHOH-CHOH-COOH.
Attention le mot courant « tartre » qui correspond au calcaire (CaCO3) qui se dépose sur les canalisations ou les bouilloires n’a aucun lien avec l’acide tartrique. Le nom « crème de tartre » provient des dépôts de tartrate sur les cuves en fin de processus de vinification.
(iv) L’acide citrique de formule HOOC-CH2-C(OH)COOH-CH2-COOH est un triacide de pKa 3,0 ; 4,4 ; et 5,7. Sa 1ère acidité est plus forte que celle de H2P2O72- et sa réaction sur HCO3- est totale.
Pour en savoir plus
[1] Zoom sur l’amidon sur le Site Mediachimie
[2] Bicarbonate de sodium - produit du jour (sur le site de la Société Chimique de France)
[3] Hydrogénocarbonate de sodium sur le site L’Élémentarium : propriétés, fabrication industrielle, applications
[4] le bicarbonate Solvay® (PDF) sur le site de Solvay
En plein hiver et particulièrement dans les régions très froides et montagneuses, il est nécessaire de lutter contre le manque d’adhérence des pneumatiques des véhicules sur sol gelé. On observe alors un ballet de saleuses, qu'on ne doit pas dépasser sur route. Mais que déversent-elles et pourquoi ?
Quels sont les effets du sel ?
.png)
Le sel ou chlorure de sodium de formule chimique NaCl, est soluble dans l’eau liquide. On appelle saumure le mélange liquide eau-sel. L’eau pure devient solide à 0°C sous la pression atmosphérique. Mais si l’eau est salée, ce mélange devient solide à une température inférieure à 0°C.
Ce phénomène est traduit par la courbe de congélation (ci-contre) qui indique la température pour laquelle l’eau devient de la glace, en fonction de la teneur (1) en sel dans le mélange. Comme le montre cette courbe, plus on ajoute de sel, plus la température de congélation baisse. Mais il y a une limite, repérée par le point E, nommé eutectique ! (2) Ainsi inutile de mettre plus de 23 g de sel pour 100 g de mélange, car les cristaux de sel ajoutés restent solides sans pour autant abaisser davantage le point de congélation. Donc ne gaspillons pas !
Et s’il fait une température inférieure à - 21°C, on a beau mettre du sel, la glace ne fond pas (3). Dans la pratique l’ajout de sel n’est plus efficace pour dissoudre la glace en dessous de -10°C, le phénomène de dissolution étant trop lent.
Les salages des routes
Les salages préventifs (la baisse de température est annoncée et imminente) se font pour empêcher l'eau de geler sur la chaussée, pour des températures entre -2° et -8°C.
Les salages curatifs (le verglas ou la neige sont déjà là !) se font avec un mélange de chlorures de sodium, de calcium (CaCl2) ou de magnésium (MgCl2), pour des températures inférieures à -8°C. En effet avec ces sels, les courbes de congélation des mélanges eau/sel de calcium ou magnésium ont des températures eutectiques plus basses (4).
L’épandage par une saumure liquide préalablement préparée, permet une diminution de la quantité de sel utilisée et son effet est beaucoup plus rapide. Il faut des saleuses adaptées.
En Amérique du Nord et au Canada, il est utilisé presque exclusivement du chlorure de calcium, compte tenu des températures hivernales très basses.
Les quantités de sel (NaCl) utilisées sont considérables
Elles varient selon les conditions météorologiques et selon qu’il s’agit d’un traitement préventif ou curatif : la fourchette va de 10 g à 15 g voire 20 g de sel par m². En France les quantités consommées sont de l'ordre 500 000 t à 1 Mt suivant les hivers plus ou moins froids.
Dans les agglomérations françaises, le sel représente l’essentiel des produits fondants utilisés (>99,5%). Environ 51% de la production mondiale de sel est consacrée à l'entretien des routes dans les pays froids. Le sel est actuellement le fondant de verglas le plus économique (environ 80 € la tonne).
Environnement
Ce sel engendre une pollution saline des bords de route, des eaux de surface, mais aussi des nappes phréatiques. Cela a un impact sur les sols, perturbe le système racinaire des plantes, bouscule les écosystèmes aquatiques (rivières et lacs) et favorise la corrosion de certaines infrastructures métalliques.
Différents produits alternatifs (majoritairement des composés organiques) sont recherchés et testés à la fois sur leur efficacité pour la viabilité des routes et sur leur impact environnemental (biodégradabilité, influence sur la demande biochimique en oxygène, …). Il faut aussi que leurs coûts restent compétitifs.
Par exemple, des formiates de sodium, HCOONa ou de potassium, HCOOK, déjà utilisés au Canada et en Finlande, sont très efficaces mais leur biodégradabilité reste un souci et ils sont respectivement 12 et 22 fois plus chers que le sel.
L’Estorob Bio D-Icer est une huile végétale à base de colza, déjà principalement utilisé dans les aéroports. Ce produit est à la fois biosourcé et biodégradable et s'avère 7 fois moins corrosif que le formiate de potassium et l'acétate de potassium. Il n'est pas corrosif vis-à-vis des métaux et freins carbone des avions. Mais il est aussi 11 fois plus cher que le sel (5).
De nombreuses autres études et essais pour des solutions plus écoresponsables sont réalisés de par le monde et la route de « cinquième génération » dotée de multiples fonctionnalités est à venir ! (6)
Françoise Brénon et l'équipe Question du mois
(1) Il s’agit plus précisément de la fraction massique, w, définie par :
w = masse du sel / masse du mélange eau-sel
(2) La lettre E pour Eutectique, qui signifie en grec « qui fond bien ». En effet l’abscisse du point E correspond à la fraction massique eutectique pour laquelle le mélange eau/sel a la température de fusion/congélation la plus basse, appelée température eutectique.
(3) En dessous de -21°C, selon les proportions en sel ajouté, il ne coexiste que des solides : eau solide (glace), NaCl solide ou solides en mélanges hétérogènes.
Dans la pratique on peut déverglacer un sol jusqu’à -30°C avec du chlorure de calcium ou du chlorure de magnésium car leurs températures eutectiques valent respectivement environ -51 °C et -33°C.
(5) On consultera avec intérêt l’étude sur la phytotoxicité de produits alternatifs au sel de déneigement (PDF) réalisée par l’ENSAIA et l’Université de Lorraine.
Voir Les infrastructures des transports : les apports de la chimie dans les projets d’avenir, Henri Van Damme (pages 34 et suivantes).
On entend parler de bon et de mauvais ozone ; cette question a-t-elle un sens ?
Première phrase rencontrée : Le trou de la couche d’ozone nous met en danger, l’ozone est « bon ».
L’ozone dit stratosphérique (*) se forme dans la haute atmosphère sous l’action des rayonnements UV (ultraviolet) très énergétiques provenant du soleil (**). En absorbant des rayonnements UV-C, une petite quantité de dioxygène O2 se transforme en ozone O3. Celui-ci instable, redonne en partie du dioxygène, en absorbant d’autres rayonnements UV-C. Il s’établit naturellement un équilibre dynamique d’équation :
3 O2 = 2 O3
Il se créé ainsi une « couche d’ozone » essentiellement présente entre 20 et 40 km d'altitude et de concentration comprise entre 2 et 8 ppm.
Ainsi, l’ozone stratosphérique est indispensable car il nous protège de rayonnement solaire ultraviolet.
Toute perturbation de cet équilibre faisant diminuer la teneur en ozone en la consommant par des réactions parasites est donc source de danger. La Fondation belge contre le Cancer rappelle que plus la couche d'ozone est mince, moins elle arrête les rayons UV, et plus l’intensité du rayonnement UV est intense à la surface du sol terrestre. C'est au-dessus de la Nouvelle-Zélande et de l'Australie que la couche d'ozone est la plus mince [1]. Les modèles informatiques prédisent qu’une diminution de 10 % de la concentration d’ozone stratosphérique pourrait provoquer chaque année 300 000 cancers cutanés, 4500 mélanomes et entre 1,60 million et 1,75 million de cas de cataracte de plus dans le monde [2]. Sans compter que les UV-B ont aussi des répercussions importantes sur les animaux, les organismes marins et les végétaux.
La mise en évidence en 1974 de la responsabilité des CFC (chlorofluorocarbure) dans la destruction de l’ozone stratosphérique (formation d’un trou au niveau de l’Antarctique au cours du printemps austral) a conduit aux accords de Montréal en 1987, limitant leur utilisation. Les scientifiques prévoient que la couche d’ozone dans l’Antarctique ne retrouvera son niveau initial (d’avant les années 1980) que vers 2050 à 2070, car la durée de vie des CFC est importante [3].
Deuxième phrase rencontrée : La présence d’ozone nous met en danger : l’ozone est « mauvais ».
C’est dans les années 1970 que Paul Crutzen (prix Nobel de chimie en 1995) montra que l’ozone est à la fois produit mais aussi détruit dans la troposphère (basses couches de l’atmosphère (*)) grâce à des réactions photolytiques (action de la lumière, ici UV-B) faisant intervenir des oxydes d’azotes [4].
| D’une part production d’ozone | D’autre part consommation d’ozone |
NO2 → NO + O● | NO + O3 → NO2 + O2 |
Les oxydes d’azote proviennent essentiellement des secteurs de l'industrie et de la production d'énergie (chauffage urbain entre autres) mais aussi des gaz d’échappement des véhicules à essence et diesel malgré l’usage des pots catalytiques qui en limitent le rejet [5].
Des études postérieures montrent que la formation d’ozone est également liée à la présence de Composés Organiques Volatils (COV), dont 10 % sont issus des activités industrielles et urbaines et 90 % sont d’origines naturelles (***) [6].
Ainsi l’ozone troposphérique est un polluant secondaire issu des polluants primaires que sont les NOx et les COV.
Concrètement la formation d’ozone dépend à la fois des quantités d’oxydes d’azote NOx et de COV présents dans la troposphère mais aussi du rapport de la quantité de COV par celle de NOx.
Cette chimie complexe explique que si l’ozone se forme en milieu urbain essentiellement par la présence des oxydes d’azote sa concentration n’y est pas maximale mais qu’elle l’est en milieu rural proche de la ville car la production de COV par la végétation y est plus forte et celle de NOx plus faible [6], [7].
En quoi cette accumulation d’ozone, accentuée depuis l’ère industrielle est-elle néfaste ?
C’est d’abord un gaz à effet de serre qui va donc participer au réchauffement de la troposphère [6].
C’est aussi un puissant agent oxydant pouvant générer des radicaux hydroxyles (HO●) selon les réactions [7]
O3 → O2 + O● suivi de O● + H2O → 2 HO●
Ces radicaux hydroxyles ont une grande importance sur la santé humaine, en provoquant des problèmes respiratoires et des irritations ophtalmiques.
L’ozone intervient aussi dans le dépérissement de la forêt [8] et nos productions alimentaires souffrent de l’augmentation de ce polluant dans la troposphère ; ainsi la production des tomates ou du blé pourraient être diminuée de 10 % dans les zones les plus polluées (Asie et pays méditerranéens) [9].
Ces dernières années des études épidémiologiques suggèrent que l’ozone troposphérique pourrait jouer un rôle dans le développement et la progression de l’insulino-résistance, associée au diabète de type 2 [10].
Du bon usage de l’ozone dans certaines applications industrielles [11].
Dans le cadre d’usage industriel, l’ozone est produit sur le site d’utilisation par décharge électrique à haute tension dans un flux d’oxygène.
L’ozone étant un oxydant puissant il est utilisé dans différentes étapes du traitement de l’eau pour obtenir de l’eau potable mais aussi pour traiter les eaux usées ainsi que de nombreux effluents industriels. Il sert pour la désinfection des eaux de certaines piscines en remplacement de l’eau de javel. Parmi les applications industrielles, on peut citer son usage dans certains procédés de blanchiment de la pâte à papier et dans l’agroalimentaire pour le blanchiment du sucre de canne.
Autres sources d’ozone et cadre professionnel [12].
Quant à la santé au travail, une attention particulière est apportée aux professionnels utilisant des appareils (imprimantes, photocopieuses, spectrophotomètres) utilisant des rayonnements UV ou laser susceptibles de former de l’ozone à partir du dioxygène.
Lydie Amann et l’équipe Question du mois
(*) La troposphère est la partie de l’atmosphère comprise environ entre 0 et 15 km de la Terre. La stratosphère est comprise environ entre 15 km et 50 km de la terre.
(**) Les rayonnements sont caractérisés par leur longueur d’onde exprimée en nanomètres (nm) : UV-B : 280−315 nm ; UV-C : 100−280 nm. Les UV C sont les plus énergétiques.
(***) COV liés à l’activité humaine et industrielle : évaporation d’hydrocarbures lors du raffinage, ou de solvants organiques ou de carburants imbrûlés non retenus par les pots catalytiques ;
COVB ou COV biogéniques, d’origine naturelle : émis par les plantes ou certaines fermentations végétales ou animales. Ils se biodégradent plus ou moins lentement.
Pour en savoir plus :
(1) Rayonnement ultraviolet, site de la Fondation contre le Cancer
(2) Effets du rayonnement UV sur la santé, site de l’Organisation mondiale de la santé
(3) 2019 Ozone Hole is the Smallest on Record Since Its Discovery, site de la NASA (National Aeronautics and Space Administration)
(4) Le prix Nobel 1995 couronne la chimie vitale de la stratosphère, L’Actualité chimique n° 192 (décembre 1995) p. 57
(5) Les oxydes d’azote (NOx) : définition, sources d’émission et impacts, site de l’ADEME (Agence de la transition écologique)
(6) Les défis de la santé et du bien-être en ville : pollution atmosphérique, nuisances thermiques, odeurs, de Jacques Moussafir, in La chimie et les grandes villes (EDP Sciences 2017), pp. 193-216
(7) L'ozone troposphérique : production/consommation et régimes chimiques, de Marie Camredon et Bernard Aumont, Pollution atmosphérique, n° 193 (janvier-mars 2007) pp. 51-60 (voir Figure 2 : Profil type de la vitesse de production d'ozone en fonction de la quantité de NOx)
(8) État des forêts d’altitude en relation avec la pollution de l’air par l’ozone dans la région niçoise, de Laurence Dalstein-Richier et al., Pollution atmosphérique, n° 193 (octobre-décembre 2005) pp. 503-519
(9) Impacts de l’ozone sur l’agriculture et les forêts et estimation des coûts économiques, de Jean-François Castell et Didier Le Thiec, Pollution atmosphérique, n° 229-230 (avril-septembre 2016) pp. 142-152
(10) Pollution atmosphérique et diabète… Quel lien possible ? Une exposition expérimentale à l’ozone chez le rat induit une insulino-résistance périphérique, de Roxane E. Vella, Alain Géloën et Christophe O. Soulage, Pollution atmosphérique, n° 231-232 (octobre-décembre 2016) pp. 105-116
(11) Oxydation et réduction appliquée au traitement de l’eau- Ozone, de Sylvie Baigh et Pierre Bouchet, Techniques de l’ingénieur, mars 2017
(12) Ozone : Fiche toxicologique n° 43, site de l’INRS (Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles)
Différentes sortes d’agents infectieux provoquent maladies et infections chez l’Homme. Cela peut être des parasites, des champignons, des bactéries, des virus. On a aussi eu le prion, il y a plusieurs années.
Les parasites
Les parasites sont des êtres vivants qui vivent aux dépens d’un autre organisme appelé l’hôte. Par exemple, le sarcopte responsable de la gale, qui est un acarien (Fig. 1), les vers comme le ver solitaire, des protozoaires comme l’agent de la malaria. Ce sont tous des eucaryotes (1) ce qui signifie que leurs cellules ont un noyau, comme les nôtres.
Les champignons et les levures
L’infection provoquée par les champignons et les levures est alors appelée une mycose ou une infection fongique. Champignons et levures sont aussi des organismes pluricellulaires eucaryotes. Ils causent des maladies souvent de la peau (teigne) et des muqueuses (bouche, muqueuses génitales), mais peuvent aussi causer des infections bien plus graves des organes internes comme les poumons (Aspergillus fumigatus par exemple) (Fig. 2).
Les bactéries
Louis Pasteur, Robert Koch sont des pionniers de la bactériologie. Les bactéries (2) ne sont pas des eucaryotes, mais des procaryotes (3), qui n’ont pas de noyau. Ce sont les plus connus des agents infectieux : Escherichia coli, Staphylococcus aureus (staphylocoque doré), Vibrio cholerae (bactérie du choléra), Mycobacterium tuberculosis (tuberculose). Comme les bactéries diffèrent des cellules humaines, les médicaments qui les éliminent sont moins toxiques que les antiparasitaires ou les antifongiques. Mais le problème est la résistance bactérienne : les bactéries devenues résistantes ne sont plus éliminées par les antibactériens et l’infection ne guérit pas. C’est devenu un problème très important.
Parasites, champignons, bactéries sont tous des organismes vivants, capables en général de vivre et de se multiplier dans un milieu nutritif acellulaire : un peu de sucre, de graisse et de protéines (bouillon de culture).
Les virus
Schématiquement, les virus (4) sont des sacs contenant des molécules biologiques, acides nucléiques, protéines ; plus exactement, ce sont des acides nucléiques enfermés dans une capside protéique (Fig. 4 et Fig. 5) ; ils n’ont pas de système métabolique (5). On dit alors qu’ils ne sont pas vivants, en ce sens qu’ils ne peuvent pas vivre et se multiplier dans un bouillon de culture comme le font les agents précédents. Ils ont besoin d’une cellule hôte « qui fait le travail pour eux » : quand ils y entrent, ils lui transmettent leur acide nucléique, ADN (6) ou ARN (7). Pour cultiver les virus, on cultive des cellules, puis on les infecte par le virus. Une fois fixé sur la cellule, le virus va fusionner avec elle. À ce moment, il libère à l’intérieur de la cellule son acide nucléique, et c’est la machinerie enzymatique de la cellule infectée qui se chargera de répliquer ces acides nucléiques et in fine d’aboutir à un ARN messager traduit en protéines pour le compte du virus. On va ainsi synthétiser d’autres virus, qui vont se créer une enveloppe au moyen de celle de l’hôte (Fig. 7), sortir et se disséminer. La cellule hôte est ainsi affaiblie, ce qui conduit le plus souvent à sa mort par lyse (8) : elle éclate, libérant les particules virales qui vont infecter d’autres cellules, etc.
Parmi les virus capables d’infecter l’Homme, il y a ceux qui donnent la grippe ou plutôt les grippes, la poliomyélite, l’hépatite A (jaunisse), la fièvre jaune, la variole, le SIDA, le virus Ebola (fièvre hémorragique), les virus oncogènes - capables d’entraîner des cancers, etc. Ils sont responsables de nombreuses épidémies et même pandémies, souvent respiratoires apparues depuis un siècle, la première étant la grippe espagnole de 1918, qui a causé près de 30 millions de morts. En 1957-1958, la grippe asiatique a entrainé 2 millions de morts ; en 1968-9 la grippe de Hong-Kong, 1 million. Durant les six dernières années, nous avons eu au moins six grandes épidémies.
Et le coronavirus ?
Son nom officiel est coronavirus SARS-CoV-2, en français SRAS pour Syndrome Respiratoire Aigu Sévère. Le nom « Covid-19 « que l’on trouve parfois désigne la maladie et non le virus qui la provoque, 19 indiquant l’apparition en 2019. C’est un coronavirus (9), car l’enveloppe virale (Fig. 4 et Fig. 5) est « décorée » de protéines qui forment des protubérances, dont le cliché en microscopie électronique rappelle les images de la couronne solaire. Ce sont ces protéines qui permettent au virus de se fixer sur la cellule et d’y entrer. Les coronavirus sont des virus à ARN. Ils ont été découverts dans les années 1930 dans des élevages de volailles où ils causent diverses infections. On connaît 7 coronavirus responsables de maladies chez l’Homme, allant d’infections de l’appareil respiratoire bénignes (rhumes et maux de gorge) à graves et à très graves (SARS et MERS).
Ces coronavirus sont d’origine animale, probablement les chauves-souris, puis transmises à des mammifères (civette, dromadaire…) ou à des oiseaux (volailles de marché en Chine). Une fois franchie cette barrière entre espèces, la transmission d’homme à homme devient très facile. Pour le SARS-CoV-2, on compte à ce jour plus de 9.600.000 cas et près de 500.000 morts dans le monde, les pays les plus touchés étant les USA avec 2.400.000 cas et 120.000 morts, puis le Brésil, le Royaume Uni, l’Italie, la France, l’Espagne, respectivement 54.900, 44.500, 34.600, 29.700, 28.300 morts (10).
Nicole Moreau et l'équipe Question du mois
Notes :
(1) Du grec eu, bien et karuon, noyau
(2) Du grec bacterion, qui veut dire bâtonnet
(3) Du grec pro, avant et karuon, noyau
(4) Du latin virus, venin ; mot établi au XVIe siècle par Antoine Paré
(5) Du grec metabolein. Le métabolisme est l’ensemble des réactions de synthèse, génératrices de matériaux (anabolisme), et de dégradation, génératrices d'énergie (catabolisme), qui s'effectuent au sein de la matière vivante à partir des constituants chimiques fournis à l'organisme par l'alimentation et sous l'action de catalyseurs spécifiques.
(6) ADN : acide désoxy-ribonucléique
(7) ARN : acide ribonucléique
(8) Du grec lusis, action de délier, dissoudre.
(9) Il n’est pas le seul coronavirus, mais est l’un des plus gros, mesurant de 50 à 200 nm de diamètre.
(10) la date du 26 juin 2020 (https://gisanddata.maps.arcgis.com )

Figure 1 : Aceria anthocoptes, image obtenue par microscopie électronique à balayage
Source : Wikimedia

Figure 2 : Aspergillus fumigatus vu au microscope électronique.
Source : Wikimedia

Figure 3 : Différents types de procaryotes
Source : Maulucioni /Wikimedia (licence CC BY-SA 3.0)

Figure 4 : Représentation schématique d’un virus (HIV)
Source : wikimedia

Figure 5 : Représentation schématique d’un coronavirus
Source : https://www.scientificanimations.com (licence BY-SA 4.0)
Le « slime », cette pâte visqueuse avec laquelle les enfants et les adolescents aiment jouer, fait l’objet d’un très grand nombre de vidéos sur Internet, qui présentent des protocoles variés pour sa réalisation. De nombreuses entreprises se sont également engouffrées dans la brèche et proposent des kits regroupant les substances nécessaires à sa confection, ainsi que de quoi le colorer et le texturer.
De la colle au « slime » ou avec quoi en fabriquer ?
Un des protocoles de confection consiste à dissoudre un peu de colle blanche dans un petit volume d’eau, d’ajouter quelques gouttes de collyre ophtalmique et d’homogénéiser vigoureusement (1).
L’ensemble s’épaissit, se décolle des parois du récipient en verre et prend la consistance liquide/solide caractéristique du « slime ».
Les procédés varient, mais tous présentent plusieurs points communs. Dans tous les cas il faut :
- de la colle PVA (pour polyvinylacétate), ou une autre substance comme de l’amidon présent dans la maïzena ou la farine, ou encore de la gomme de cellulose présente dans le dentifrice ;
- de l’eau ;
- un additif : collyre ophtalmologique ou du carbonate de calcium ou des tensioactifs anioniques présents dans le liquide vaisselle.
Quelles sont les caractéristiques et le rôle de chacun de ces ingrédients ?
La colle blanche
La colle blanche est une émulsion de PVA dans l’eau. Le PVA est un polymère constitué de molécules organiques de grande taille, appelées macromolécules. Celles-ci sont insolubles dans l’eau. La colle blanche a été obtenue en ajoutant de l’eau et un tensioactif, afin que les macromolécules se trouvent dispersées en fines gouttelettes dans l’eau. Ainsi elles ne s’agglomèrent pas en une phase unique, ce qui donne à la colle ses propriétés mécaniques d’écoulement et sa relative fluidité.
D’un point de vue structural, la macromolécule constituant le polymère PVA est décrite par la répétition d’un motif comportant une fonction acétate [–(CH2–CH(OCOCH3))–]. Une chaîne est schématisée ci-après :

Lorsque la colle sèche, l’eau s’évapore et les macromolécules forment un réseau enchevêtré à 3 dimensions. Les macromolécules présentent alors de nombreuses interactions des unes avec les autres (2), ce qui confère sa rigidité au matériau. L’image d’un plat de spaghettis cuits congelés permet de se figurer cet état figé caractéristique de la colle sèche !
Ajouter de l’eau à la colle
En rajoutant de l’eau à la colle, les macromolécules sont encore plus espacées les unes des autres, la suspension se comporte alors comme un véritable liquide, assez visqueux. Les spaghettis nagent dans l’eau !
Le collyre ophtalmique et son rôle

Le collyre ophtalmique est une solution aqueuse de borax (Na2B4O7, 10 H2O) et d’acide borique. Il se créé in situ des ions borates B(OH)4– dont la présence assure au « SLIME » ses propriétés mécaniques ludiques. En effet, les ions borate créent des ponts, ou réticulations, entre les chaines. Il s’agit d’un nouveau réseau d’interactions faibles, majoritairement des Liaisons Hydrogène, (LH) (3) entre les macromolécules.
Les chaines ne sont plus aussi libres que dans la colle diluée à l’eau mais elles gardent une certaine cohésion, ce qui donne l’aspect visqueux du « slime ». En revanche, ces liaisons restent faibles, elles peuvent se rompre et se reformer facilement.
Les différences de propriétés entre la colle séchée, la colle liquide et le « slime »
Rappelons qu’ils sont tous les trois constitués des mêmes macromolécules. Les différences proviennent de plusieurs points.
• Dans la colle séchée, il n’y a qu’un réseau 3D de macromolécules de PVA. L’ensemble est donc solide, car les chaines ne peuvent glisser les unes sur les autres.
• Dans la colle liquide, les macromolécules sont espacées, non emmêlées, ce qui lui confère son caractère liquide (quoique visqueux).
• Dans le « slime », il y a de l’eau, ce qui espace les chaines et leur permet de glisser les unes sur les autres. Les points de réticulation assurent à la matière une certaine cohésion tout en restant rompables et reformables. Le « slime » se comporte à la fois comme un solide et comme un liquide.
Quelques expériences expliquées
- Doubler la quantité d’eau de la recette : le « slime » devient trop liquide.
- Ne pas ajouter d’eau du tout : au contraire le « slime » est trop compact, cassant, les chaines ne peuvent plus autant « glisser les unes sur les autres ».
- Mettre une galette de « slime » sur un verre renversé : la substance s’écoule comme un liquide.
Le déposer dans un récipient : il en prend lentement la forme.
Posé sur une surface lisse, le gel s'étale très lentement en forme de flaque circulaire.
Dans tous ces cas, le « slime » se comporte comme un liquide visqueux. Les macromolécules glissent doucement les unes contre les autres mais les liaisons hydrogène assurent la cohésion de l’ensemble. - Lorsqu'on laisse évoluer le « slime » sous son propre poids, il s'étire doucement : il flue (coule) sans se rompre. En effet, les LH ne suffisent pas à rendre le solide rigide et indéformable.
- Lorsqu'on tire dessus d'un coup sec il se coupe net car les LH ne sont pas très fortes. Une fois cassé on peut le reformer en un seul morceau car la rupture des LH est réversible. Deux morceaux de gel peuvent ainsi rapidement fusionner lorsqu'on les accole.
- Mettre une boule de « slime » dans le creux de sa main et enfoncer rapidement son doigt dedans : une empreinte est réalisée comme dans le cas d’un solide. La viscosité augmente lorsqu’une contrainte mécanique lui est appliquée, car on contraint les chaines de macromolécules à s’enchevêtrer.
- Si on lance la boule, celle-ci rebondit assez bien sur une surface lisse, sans se déformer. Toutefois le « slime » n'est pas vraiment élastique au point de rebondir fortement. En effet pour cela il faut utiliser des chaînes macromoléculaires bien plus longues.
Antoine Éloi et l’équipe question du mois
(1) Consignes de sécurité : ne vous touchez pas le visage ni les yeux durant vos expériences, ne mangez pas les produits et lavez-vous les mains à la fin. Plus d’infos sur : le Dacryosérum, l’acétate de vinyle et le PVA.
(2) Entre les macromolécules il peut y avoir des interactions électrostatiques qui les retiennent les unes aux autres. Il s’agit des interactions de Van der Waals.
(3) Les LH sont des interactions qui s’établissent ici entre certains atomes d’oxygène des macromolécules et les groupes OH des ions borate (figurées en hachures rouges).
Illustration : jarabee123 / Adobe Stock
La radioactivité a été découverte par un français Henri Becquerel en 1896 qui a constaté qu’en enveloppant un minerai d’uranium d’un papier photographique, celui-ci était impressionné en l’absence de toute lumière par un rayonnement inconnu qu’il a baptisé radioactivité.
C’est une propriété d’isotopes instables comme l’uranium 238 (238U) ou le thorium 232 (232Th). Marie Curie découvrit plus tard cette même propriété pour le radium (Ra). Les atomes radioactifs comportent dans leur noyau un nombre de nucléons (protons + neutrons) qui rend ce noyau instable. Pour retrouver une configuration stable ils émettent de l’énergie par rayonnement α (noyaux d’hélium, He), β (électrons) ou γ (photons).
La première unité de mesure de la radioactivité fut le becquerel 1 Bq qui correspond à une désintégration par seconde. L’activité d’une source peut s’exprimer en Bq ou en Bq/kg activité massique (1). Notre corps est lui-même radioactif d’environ 120 Bq/kg. Si vous pesez 70 kg, l’activité est d’environ 8 000 Bq due principalement au potassium 40 (40K) et au carbone 14 (14C).
Ce qui est plus important c’est la dose de radioactivité absorbée par une cible, en joules par kilogramme (J/kg). Anciennement appelée rad pour Radiation Absorbed Dose (rad) elle est actuellement, dans le système international (SI) exprimée en gray (Gy) :
1 Gy = 1 J/kg = 100 rad.
Elle trouve son utilité en radioprotection. On définit alors la dose efficace qui est la somme pondérée des doses équivalentes (des rayonnements α, β et γ) absorbées par les organes et tissus humains. Elle est exprimée dans le système international en sievert (Sv) (2) ou son millième, le mSv, unité universellement admise pour la mesure d’exposition à la radioactivité et risques d’apparitions de dégradations de la santé.
Les facteurs de radioactivité
Sur terre nous sommes exposés à plusieurs facteurs. Tout d’abord les rayonnements cosmiques qui nous arrivent du Soleil et de l’espace, le rayonnement tellurique issu des réactions du noyau terrestre et aussi le radon, un gaz lourd radioactif plus ou moins présent dans le sol et le sous-sol, particulièrement dans les régions granitiques. N’oublions pas nos propres activités humaines : si vous passez une radiographie ou un scanner vous êtes exposés aux rayons X (analogues au rayonnement γ), si vous skiez en altitude ou si vous faites des voyages en avion vous serez exposés à plus de rayons cosmiques. Enfin votre propre alimentation vous fait absorber le 40K présent dans les aliments.
| Sources | en mSv par personne et par an |
| Radon | 1,4 |
| Examen médical | 1,6 |
| Rayonnement telleurique | 0,6 |
| Rayonnement cosmique | 0,3 |
| Alimentation | 0,5 |
| Dose moyenne | 4,4 |
Le tableau montre les principales sources et les moyennes, Il peut y avoir de fortes variations suivant les régions habitées, l’altitude fréquentée, l’alimentation absorbée et le comportement individuel.
Quelques exemples et de fausses idées
Pour le radon, dans une cave dans le Cantal, en Lozère ou en Bretagne vous pouvez mesurer des valeurs très variables de 0,5 à 3 mSv. Une radiographie des poumons ou de l’abdomen peut donner des valeurs comprises entre 0,5 et 1,2 mSv, un scanner beaucoup plus. Un voyage aller et retour Paris – New-York, 0,06 mSv, un séjour de ski d’une semaine à 2000 m correspond à 0,25 mSv.
La dose admise réglementairement d’exposition annuelle pour la radioactivité artificielle est de 1 mSv. C’est une norme et ne correspond en rien à une limite dangereuse. Celle-ci est de 100 mSv et correspond à la zone rouge pour la protection des travailleurs du nucléaire pour lesquels on fixe une limite de 20 mSv cumulés sur les 12 derniers mois pour qu’il n’y ait aucune répercussion sur leur formule sanguine.
Les mesures de la radioactivité de l’air se sont multipliées depuis les années 2000, elle est de l’ordre de 100 nSv/h (nSv = nanosievert ou 10-6 mSv). Le réseau de l’IRSN (3) donne pour les grandes villes françaises des valeurs comprises entre 112 et 130 nSv/h. Les retombées radioactives des expériences nucléaires en atmosphère qui ont eu cours jusque dans les années 1970 et l’accident de Tchernobyl en 1986 ne contribuent actuellement à la radioactivité des sols que pour 0,05 mSv, en constante diminution. Les anciens postes de télévision à tube cathodique émettaient des rayons X et pouvaient contribuer à 0,02 mSv par an pour le téléspectateur, les écrans plats n’émettent plus.
D’autres exemples : fumer une cigarette représente 7µSv à cause des goudrons. Combien en fumez-vous ? Si vous mangez beaucoup de crustacés et de coquillages vous absorbez l’iode 131 et le polonium 210 présent dans l’eau de mer mais cela se chiffre en nano et microsievert rassurez-vous. Dans tous les cas le citoyen français en moyenne ne reçoit que de 3 à 4 mSv par an, surtout par radioactivité naturelle, soit une exposition 25 fois plus faible que la dose dangereuse.
Jean-Claude Bernier et l'équipe Question du mois
(1) À côté du becquerel d’autres unités ont été utilisées. Ainsi le curie (Ci) représentant l’activité d’un gramme de radium, soit 1 Ci = 37 109 Bq.
(2) L’ancienne unité pour la dose équivalente et la dose efficace était le rem, pour « röntgen equivalent man ». 1 Sv = 100 rem
(3) IRSN : Institut de Radioprotection et de Sûreté Nucléaire
En 2003 la directive européenne RED (Renewable Energy Directive) a demandé aux pays européens des réductions d’émission de gaz à effet de serre (GES), notamment pour le transport, en faisant appel aux biocarburants capables de diminuer de 35% en 2017 puis de 50% en 2018 les émissions. Les pétroliers ont alors ajouté de l’alcool dans l’essence et des esters d’huiles végétales dans le gasoil, d’origine biosourcée.
Comment fabrique-t-on le bioéthanol (selon les procédés dits de 1re génération) ?
L’éthanol ou alcool éthylique, de formule chimique C2H5OH, est principalement synthétisé lors de la fermentation du sucre, soit de canne à sucre, soit de betterave suivant la réaction :
ou à partir d’amidon de blé ou de maïs, préalablement hydrolysé en sucre, selon :
(C6H10O5)n + n H2O = n C6H12O6 suivi de la fermentation (1).
Lors de ces réactions, l’alcool obtenu est mélangé à de l’eau que l’on doit absolument éliminer.
Pour cela l’opération industrielle se poursuit par une distillation pour obtenir un mélange eau-alcool à 90% (2) en éthanol. Puis les 10% d’eau restants sont éliminés sur tamis moléculaires pour que l’alcool purifié à 99,8% puisse être mélangé à l’essence. Les pétroliers en transforment une partie en ETBE (éthyl ter-butyl éther) (3) par réaction avec l’isobutène (4) afin d’avoir un carburant moins volatil.
Le rendement énergétique de l’éthanol est inférieur à celui de l’essence. En effet le rendement avec un litre et demi d’éthanol équivaut environ à celui d’un litre d’essence. Il faut donc s’attendre pour une automobile à une consommation supérieure au 100 km.
Les différents carburants à la « pompe à essence » : pour quels moteurs ?
En France les différents carburants à essence contiennent des quantités variables d’alcool.
Nom du carburant | SP 95 | SP 98 | SP95 E10 | super éthanol E 85 |
| Logo à la pompe depuis octobre 2018 | E5 | E5 | E10 | E85 |
Pourcentage maximum d’éthanol pur | 5 % | 5% | 10 % | 65 à 85 % selon la saison |
Tous les moteurs modernes sont conçus pour fonctionner avec les 3 premiers carburants.
Par contre pour le E85 il faut une automobile dite « flexfuel » équipée d’un système d’injection et de réglages du moteur lui permettant d’utiliser tous les carburants modulables. Seuls quelques constructeurs commercialisent ces véhicules qui ne représentent à l’achat que 0,3% du neuf. Heureusement depuis 2018 des boitiers électroniques agréés s’adaptent sur les autres automobiles leur permettant de rouler à l’E85 et environ 6000 automobilistes par an y recourent. C’est qu’ils recherchent des économies et une rentabilité car l’E85 est bien moins taxé que l’essence normale (0,12 € au lieu de 0,68 €) ce qui donne un prix moyen de 0,70€/L à la pompe pour l’E85.
Pour une voiture consommant 6 L/100 km de SP 95 à 1,50€/L et équipée pour rouler avec 7L/100 km d’E85 à 0,70 €/L, l’économie est de l’ordre de 4 €. Il faut alors de 20 000 à 25 000 km pour rentabiliser la pose du boitier FlexFuel d’environ 1000€.
[Ajout octobre 2020 : Les données actualisées mensuellement sont disponibles sur le site du Syndicat National des Producteurs d'Alcool Agricole, notamment sur la répartition de l’utilisation des carburants et les coûts et gains d’utilisations du SP95-E10 et du Superéthnol-E85. En 2020, l’estimation d’installations de boitiers est de 3000 par mois.]
Concurrence entre cultures à des fins énergétiques et cultures alimentaires
Alors « sauverons-nous la planète » (5) en roulant au bioéthanol ? La polémique a grossi dès 2010 après des rapports américains qui dénonçaient l’utilisation de cultures vivrières à des fins énergétiques et s’est enflée en 2016 après une étude très documentée de l’ADEME, de l’INRA et d’une ONG « Transport et environnement » pour la Commission de Bruxelles. Non seulement les gains en émission de GES étaient très inférieurs à 30% pour l’éthanol issu des céréales – avec de grandes disparités selon les céréales - mais le chiffrage du CAS (Changement d’affectation des sols) plombait encore ce bilan (6). C’est pourquoi la commission n’a pas voulu augmenter le pourcentage de biocarburants de 1re génération après 2018 comme prévu dans la directive RED.
[Ajout octobre 2020 : Une étude commandée par la Commission européenne a débouché sur la publication en mars 2019 d’un règlement délégué de la Commisssion. Les impacts sur le Changement Indirect d’Affectation des Sols sont détaillés en annexe pour les différentes cultures céréalières, sucrières et oléagineuses. Ces cultures sont classées en dessous du seuil limite de 10% définissant les biocarburants à risque ILUC élevé (risque de changement indirect d’affectation des terres), à l’exception de l’huile de palme dont la valeur est à 45%.]
Quelle est la situation en France ?
Le SP95 E10 est devenu le carburant le plus vendu avec plus de 40% des ventes à la pompe en 2019. L’éthanol représente environ 10% des carburants vendus en France.
Le dernier rapport du ministère de l’Écologie solidaire et celui de la commission parlementaire du 22 janvier précise qu’en 2017 543 millions de litres d’éthanol ont été produits, issus de matières premières française (55% maïs et blé, 33% betterave, 12% divers). De même 753 ML d’ETBE ont été produits à partir de 55% de matières françaises (80% blé et maïs, 18% betterave).
[Ajout octobre 2020 : La production française de bioéthanol utilise moins de 1% de la surface agricole utile nationale.]
Ces deux rapports recommandent d’accélérer la recherche pour l’obtention d’éthanol dit « cellulosique » produit à partir de la biomasse « lignocellulosique » issue de déchets végétaux (bois, paille, bagasses de végétaux), selon des procédés biochimiques.
Pour l’instant des cocktails d’enzymes capables de transformer la cellulose en sucres ont été trouvés et on sait à la fois séparer la lignine et mener la fermentation en bioréacteurs mais le coût de l’alcool produit n’est pas encore compétitif. En France le projet Futurol mené par 11 participants, dont l’IFPEN (8), est arrivé à son terme en 2018 après dix ans de recherche. La bioraffinerie pilote de ce projet à Pomacle-Bazancourt dans la Marne a été cédée à la société ARD (Agro Industrie Recherches et Développements) chargée de son maintien et de la commercialisation de cet éthanol cellulosique français pour le biocarburant 2G (9).
Un peu d’histoire (un retour aux sources ?)
L’inventeur du moteur à explosion, Nicolas Otton, avait conçu ce moteur avec l’alcool comme carburant et le record de vitesse automobile avait été obtenu en 1903 à 177 km/h sur une Gobron-Brillé roulant à l’éthanol. C’est seulement quand les hydrocarbures sont devenus moins chers que l’essence a remplacé l’alcool.
La production de futurs biocarburants respectant les enjeux environnementaux et économiques est un défi exaltant auquel doivent répondre les chimistes et bio-technologistes. Pour nous, automobilistes dans une société économe des ressources, quel que soit le carburant adoptons une conduite cool et écolo !
L’équipe question du mois
(1) Un schéma présentant les étapes de la production de bioéthanol est disponible sur le site SNPAA des Industriels de l'Alcool et du Bioéthanol
(2) Il s’agit de la fraction molaire en éthanol du mélange eau/éthanol
(3) Le nom ETBE est le nom industriel. Son nom selon la nomenclature est le 2-éthoxy,2-méthylpropane.
(4) La réaction mise en jeu entre l’isobutène et l’éthanol pour donner l’ETBE est

(5) Un exemple d’énergie renouvelable : l’essence verte
(6) Les enjeux de la R&D en chimie pour le domaine des carburants et biocarburants
(7) Polémiques dans le monde des biocarburants
(8) IFPEN : Institut Français du Pétrole et des Énergies Nouvelles
Il est très fréquent d’entendre parler de pile à hydrogène, de voitures à hydrogène, de véhicule « propre », de mobilité hydrogène, de mobilité verte, d’hydrogène vecteur d’énergie, d’hydrogène gris ou vert…
Mais de quel hydrogène parle-t-on ?
Il s’agit de la molécule de dihydrogène, H2, gaz qui n'existe quasiment pas à l'état naturel sur Terre.
En effet, l’élément hydrogène, de symbole H, est très abondant sur la Terre mais seulement sous forme combinée :
- soit avec l’oxygène dans la molécule d’eau, H2O,
- soit avec le carbone dans les hydrocarbures, comme le gaz naturel ou méthane (CH4) ou le pétrole ; ce sont des mélanges de composés de formules générales CnHm
- ou encore dans les molécules du vivant.
Si l’on dispose de dihydrogène, il est possible de récupérer de l’énergie soit sous forme de chaleur via sa combustion directe avec le dioxygène (1) - c’est le cas des moteurs à hydrogène - , soit sous forme d’électricité via une pile à combustible (2) . Dans les deux cas la réaction globale ne produit que de l’eau selon :
2 H2 + O2 →2 H2O
Ainsi le dihydrogène est un vecteur d’énergie mais pas une source d'énergie car n'existant pas à l'état naturel, il faut préalablement le produire à partir d’eau ou d’hydrocarbures, ce qui nécessite d’abord une dépense d’énergie.
L’hydrogène gris ou comment créer du dihydrogène à partir des hydrocarbures
Le réformage (ou reforming) du gaz naturel (3) est actuellement la principale source de dihydrogène. Du méthane et de l’eau sont mis à réagir à haute température (nécessitant donc une consommation d’énergie). La réaction mise en jeu est :
CH4 + H2O = CO + 3H2 suivie de CO + H2O = CO2 + H2
On peut aussi faire le réformage des hydrocarbures liquides (pétrole) ou du charbon (4) .
En plus de la consommation d’hydrocarbures, on notera que pour faire 1 kg d’hydrogène par réformage, on émet de 6 à 10 kg de CO2.
L’hydrogène décarboné ou comment créer du dihydrogène par électrolyse de l’eau
L’apport d’énergie électrique via deux électrodes, plongées dans de l’eau en milieu basique (ou de l’eau acidifiée), reliées aux bornes d’un générateur de courant continu, permet la décomposition de l’eau et la création de dihydrogène, selon la réaction :
2 H2O → 2 H2 + O2
Dans quel cas cet hydrogène décarboné est-il « vert » ?
Tout dépend de la source d’électricité. Si elle provient d’une centrale à charbon, d’une centrale à fuel lourd ou au gaz, cet hydrogène reste gris ! Si la source d’électricité est elle-même décarbonée et renouvelable, courant électrique provenant de barrages hydrauliques, d’éoliennes ou de panneaux solaires, on parle d’hydrogène vert.
Le grand intérêt de cette électrolyse est de permettre le stockage de l’énergie sous forme de dihydrogène pour ces sources intermittentes d’énergie avant de récupérer ultérieurement l’énergie via sa combustion dans une pile à combustible ou dans un moteur. C’est en ce sens que l’hydrogène vert participera à la transition énergétique.
Toutefois il faut garder à l’esprit que chacun des rendements de l’électrolyse et de la pile à hydrogène sont inférieurs à 1 et que le stockage consomme aussi de l’énergie (5) .
Françoise Brénon et l'équipe Question du mois
(1) La combustion du dihydrogène
Sa combustion en présence d’oxygène génère de l’eau selon 2 H2 + O2 →2 H2O, et s’accompagne d’un très important dégagement de chaleur (143 kJ pour un gramme de H2 soit trois fois plus que l’essence ou le diesel).
Comme c’est un gaz très léger, 11 fois plus léger que l’air, il faut pour l’utiliser, le comprimer très fort ou le liquéfier. C'est ainsi l'un des combustibles liquides les plus utilisés au décollage, dans les étages cryogéniques des lanceurs de fusée. Par exemple, la navette spatiale Ariane 5 emporte jusqu'à 26 tonnes d'hydrogène liquide dans ses réservoirs !
Schématiquement, la pile présente deux compartiments alimentés par du dihydrogène à l’anode et de l’air à la cathode. Quand la pile débite, la réaction globale est la même réaction que celle de la combustion directe, soit
2 H2 + O2 → 2 H2O. Voir https://www.mediachimie.org/sites/default/files/FR-pile-images.pdf
Ainsi des voitures électriques, munies d’un réservoir à dihydrogène comprimé, peuvent fonctionner avec le courant continu délivré par une pile à hydrogène, le dioxygène provenant en continu de l’air. Ces voitures, lors de leur fonctionnement, émettent seulement de la vapeur d’eau et non plus des oxydes d’azote ni de dioxyde de carbone. C’est ainsi que l’on parle de « véhicule propre ».
(3) Le réformage du méthane nécessite de travailler entre 800 et 900 °C et sous 350 bars, en présence de catalyseur à base d’oxyde de nickel sur des anneaux d’alumine imprégnés par 10 à 16 % en masse de Ni (leur durée de vie est comprise entre 8 et 10 ans).
(4) Les matières premières utilisées, dans le monde, pour produire le dihydrogène, en 2014 sont à 96 % d’origine fossile.
gaz naturel | hydrocarbures liquides | charbon | électrolyse |
49% | 29% | 18% | 4% |
(5) Globalement l’électrolyse de l’eau, le transport et la compression du gaz à 700 bars consomment environ 75 % de l’énergie que l’on aurait pu récupérer lors du fonctionnement de la pile. En effet, pour qu’un véhicule fonctionne avec une pile à hydrogène vert, il a été nécessaire en amont de faire l’électrolyse de l’eau, d’acheminer le dihydrogène à la station et enfin de comprimer fortement le gaz pour qu’il occupe un volume réduit dans la voiture. On admet que l'électrolyse de l'eau a un rendement compris entre 50 et 60 % par rapport à la puissance électrique fournie. Les rendements de l’électrolyse à haute température peuvent monter plus haut (80 à 90 %) mais il faut faire de la vapeur à 300-800 °C. Enfin il faut comprimer le gaz à 700 bars (de l’énergie est donc dépensée par le compresseur) et la température du gaz s’élève (selon la loi pV=nRT), gaz qu’il faudra refroidir après.
Les piles alcalines, les piles boutons, les batteries ont envahi notre vie de tous les jours. Elles apportent l’énergie électrique aux jouets, aux lampes torches, aux téléphones et tablettes portables, aux véhicules automobiles… Notons bien en français la distinction « pile » chargée une fois pour toute et qui se décharge à l’utilisation et « batterie » ou accumulateur qui délivre un courant grâce à une réaction électrochimique réversible et qui peut se recharger.
90 % des piles sont des piles « alcalines ». On trouve les « piles bâtons » cylindriques qui ont une anode constituée de zinc métallique (Zn) en poudre et d’un électrolyte gélifié contenant de l’hydroxyde de potassium (KOH). La cathode est constituée d’un mélange de dioxyde de manganèse (MnO2) et de carbone graphite (C) le tout enserré dans un cylindre d’acier.
Les piles boutons comportent souvent un gel de zinc et de potasse (KOH) et de l’argent (Ag), puisque le mercure (Hg) est maintenant interdit.
Les batteries rechargeables sont diverses :
- batteries nickel-cadmium (1), Ni-Cd, pour les outils de bricolage autonomes ;
- batteries nickel-hydrures métalliques de terres rares et de nickel (2), Ni–MH, pour les ordinateurs et les téléphones ;
- et de plus en plus de batteries Li-ion (3) (ion lithium) qui comportent une anode en graphite et des cathodes avec des oxydes mixtes de cobalt de type LiCoO2 , ou nickel, ou manganèse.
Sachant que l’on utilise environ 33 000 tonnes de piles et batteries en usage par an, cela représente environ 10 000 tonnes de zinc et 8 000 tonnes de fer et nickel sans oublier le cuivre.
Il ne faut donc surtout pas les jeter dans la nature ou dans les poubelles car vous dispersez alors partout des métaux lourds comme Zn, Fe, Co, Mn, et pire, des métaux pouvant être toxiques comme Ni ou Cd ainsi que des métaux rares et coûteux comme Cu, Ag et des terres rares : néodyme (Nd), praséodyme (Pr), dysprosium (Dy) et lanthane (La).
Une attitude d’éco-citoyen responsable exige aussi une économie des ressources naturelles et c’est une raison de plus pour mettre piles et batteries dans les bacs spécialisés de recyclage que l’on rencontre dans toutes les grandes enseignes de supermarchés ou de bricolage.
| Sur 100 piles utilisées | ||
| 30 sont jetées aux ordures ou dans la nature | 35 sont stockées ou en usage chez les particuliers | 35 sont recyclées par les filières existantes |
L’objectif est de développer les procédés de recyclage par broyage, puis hydrométallurgie et pyrométallurgie pour récupérer les alliages ferreux et affiner les métaux non ferreux ou rares.
Les directives européennes de recyclage sont d’en atteindre au moins 45 % par des organismes nationaux agréés, comme Corepile ou Sorelec, qui, en France, se partagent le recyclage d’un peu plus de 12000 tonnes de piles et batteries.
Dans le cas particulier de l’industrie automobile, où la plupart des véhicules sont équipés de batteries au plomb et acide sulfurique, il y a obligation de les recycler. Plus de 95 % sont désossées, l’acide est neutralisé, le plomb refondu et le polypropylène des caissons lavé et transformé en granulés recyclables.
Avec l’augmentation des véhicules électriques et des millions de tonnes de batteries ion–lithium qui s’annoncent, des filières spécialisées vont se mettre en place pour récupérer et recycler Cu, Co, Ni, Mn et Li.
Donc quand vos piles ou batteries ne fonctionnent plus, ne les jetez plus n’importe où et pensez recyclage, les chimistes s’en occupent pour une seconde vie (4).
Jean-Claude Bernier et l'équipe Question du mois de Mediachimie
(1) Une des électrodes est en oxyde de nickel hydraté NiO(OH) et l’autre est en cadmium, Cd.
(2) Une des électrodes est composée d’un hydrure métallique à base de lanthane (terre rare) et de nickel, de type LaNi5 et l’autre de l'oxyhydroxyde de nickel, NiO(OH). L’électrolyte est de la potasse.
(3) L’Académie suédoise vient de couronner en 2019 les inventeurs des batteries ion-lithium par le prix Nobel de chimie. Pour en savoir plus voir l'éditorial Un Nobel de chimie populaire
(4) Pour en savoir plus, voir la vidéo de l'ADEME ressource Comment transformer nos déchets électroniques en or et autres métaux précieux
Un clin d'œil à la chimie du réveil et du coucher
Quand le soleil se lève…
La couleur bleue du matin éveille en nous la synthèse de multiples molécules chimiques et en particulier au niveau du cerveau de nombreuses molécules dites neuromédiateurs ou neurotransmetteurs. Il s’agit de petites molécules, lesquelles, une fois synthétisées dans les cellules, sont déversées dans le liquide intercellulaire (entre les cellules) pour transmettre des messages relatifs à l’éveil et au tonus (1).
Nos humeurs, notre équilibre affectif, notre appétit, nos motivations durant la journée en dépendent fortement. La sérotonine, la dopamine comme la noradrénaline en font partie (2). Un défaut en sérotonine ou en dopamine peut conduire à des pathologies graves comme, réciproquement, la dépression ou la maladie de Parkinson.
Les sources d’alimentation influencent aussi et pour beaucoup l’approvisionnement de l’organisme en ces deux neuromédiateurs : leur biosynthèse a lieu dans l’organisme à partir des acides aminés dits essentiels c’est-à-dire apportés par la nourriture. Il s’agit du tryptophane pour la sérotonine et de la phénylalanine pour la dopamine (3). Les protéines contenant le plus ces acides aminés sont celles issus du soja, des haricots secs, des lentilles, des graines de noix, œufs, légumes, fruits, poissons et viandes. Dans l’ensemble il faut privilégier plutôt les légumes secs, les lentilles, les noix et non une alimentation hyper-protéinée.
Quand le soleil se couche…
Le soleil tombant, la couleur rougeâtre va changer les processus physiologiques.
Ainsi et à titre d’exemple la synthèse de la sérotonine va être revue à la baisse et le surplus circulant va être transformé en mélatonine (melanas en grec=encre noire), l’hormone qui va progressivement nous conduire vers les bras de Morphée (4).
La lumière, le soleil et le crépuscule remplaceraient abondamment et qualitativement nos réveils électroniques grâce à la chimie et ses impulsions par le simple déclenchement des régulations naturelles. À quand les chambres à coucher rougeâtres la nuit tombante et bleues le soleil levant ?
La preuve de concept étant presque faite, allons plus loin et imaginons des peintures intelligentes dont «l’Homme » aurait grand besoin ! Ses humeurs, son énergie, ses dépressions, son efficacité, sa prductivité au travail et son bien-être ne pourraient que s’améliorer !!
Constantin Agouridas et l'équipe Question du mois de Mediachimie
[1] L’influx nerveux (message) est ainsi transmis à partir des cellules nerveuses (neurones) vers d’autres neurones ou vers d’autres cellules de l’organisme comme les muscles…
[2] Ces trois molécules sont des amines. Leurs formules sont :
| sérotonine | dopamine | noradrénaline, isomère L (R) est seul concerné |
 |
[3] La dopamine peut dans certaines circonstances trouver un autre précurseur endogène pour sa biosynthèse : la tyrosine. Il faut noter que la source de la tyrosine dépend aussi de la phénylalanine…
Pour ces 3 acides aminés, seuls les isomères L (S) sont impliqués.
| L (S) phénylalanine | L (S) tryptophane | L (S) tyrosine |
[4]La mélatonine ou « hormone du sommeil » a pour formule
La sérotonine subit une acétylation de sa fonction amine et une méthylation de sa fonction phénol, par voie enzymatique, dans la glande pinéale ou épiphyse, selon :
Bien que la morphine, tire son nom de Morphée, cette molécule complexe, utilisée contre les douleurs intenses, n’est pas synthétisée au sein de l’organisme, mais extraite de l’opium. Elle n’appartient pas au cycle circadien.