 |
Comment traiter une eau de piscine privée ?
|
Comment traiter une eau de piscine privée ?
Rubrique(s) : Question du mois

Les beaux jours approchent et vous voulez profiter de votre piscine. Il faut donc s’assurer que son eau est saine et propre à la baignade. Et vous allez faire de la chimie sans vous en rendre compte !
L’eau dans les piscines doit avoir les caractéristiques suivantes :
- abiotique, donc aucun organisme vivant (autre que les baigneurs !),
- limpide,
- non agressive pour les baigneurs.
Quels sont les organismes vivants concernés ? Il s'agit de microorganismes (bactéries, virus, champignons...) et d'algues. Pour lutter contre ces organismes, il est nécessaire de désinfecter l’eau par l’acide hypochloreux, ClOH.
Le traitement le plus rencontré utilise des « galets de chlore »
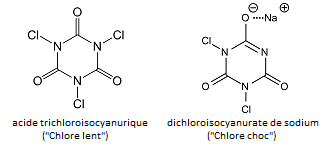
L’acide hypochloreux, ClOH, est généré in situ en introduisant des « galets de chlore » dit « lents » et « chocs » qui sont deux composés voisins, l’acide trichloroisocyanurique (TCU) et le dichloroisocyanurate de sodium (DCU) (i).
La réaction mise en jeu (par exemple pour le TCU) est : TCU + 3 H2O = 3 ClOH + acide isocyanurique (ii)
Dans les documents commerciaux, ClOH est surnommé « chlore actif ».
Le « chlore lent », peu soluble dans l’eau, permet une dissolution progressive du galet et donc une concentration faible et continue en ClOH. Pour une piscine de 55 m3, il faut deux galets de 250 g pour 7 à 10 jours.
Le « chlore choc » se dissout très rapidement permettant d’augmenter très vite, si nécessaire, la concentration en ClOH (en cas de problème d’algues ou à la sortie de l’hivernage, par exemple).
Il peut arriver qu’on observe une accumulation d’acide isocyanurique au cours du temps. Si sa concentration est trop élevée, les galets n’agissent plus. On dit alors que la piscine est « saturée ». À noter que l’acide isocyanurique est inoffensif pour la baignade (iii). Pour éviter la saturation il faut vidanger une partie de l’eau (environ 1/3) avant chaque hivernage, l’appoint sera apporté par l’eau de pluie avec éventuellement un peu d’eau du robinet.
Pour éliminer les algues, il faut ajouter des sels d’ammonium quaternaire, en combinaison avec du « chlore choc ». Un exemple de sel d’ammonium est donné en note (iv). La prolifération des algues, qui contribuent à une eau trouble et verdâtre ainsi qu’à des dépôts rendant les surfaces glissantes, est favorisée par la lumière, par une augmentation de la température et par une élévation du pH.
La régulation du pH, le plus proche de 7,2, est indispensable pour trois raisons.
- D’une part pour que l’eau ne soit pas agressive pour la peau, il faut que le pH soit compris entre 7,2 et 7,6.
- D’autre part, l’acide hypochloreux est en équilibre dans la solution avec les ions hypochlorite ClO-. Or le pouvoir destructeur des microorganismes de l’acide hypochloreux est environ 100 plus fort que celui des ions hypochlorite [1] et la teneur en acide hypochloreux chute de 66 % à 50 % lorsque le pH augmente de 7,2 à 7,5.
- Enfin il ne faut pas que le pH devienne trop acide car un dégagement de dichlore pourrait se produire (v). Ainsi, si le pH devient inférieur à 7,2, on ajoute du carbonate de sodium Na2CO3, appelé commercialement « pHplus ».
Pour avoir une eau limpide on ajoute du sulfate d’aluminium. Il permet d’agréger (vi) les particules en suspension et de faciliter la filtration ultérieure. Les galets commerciaux (environ 100 g) de ce composé sont enfermés dans un sachet non-tissé ayant l’apparence d’une chaussette. Un résidu gluant se forme dans la « chaussette » évitant d’encrasser les canalisations.
L’acide hypochloreux détruit les microorganismes mais se combine aussi aux composés organiques azotés tels que la sueur, les peaux mortes… que peuvent apporter les baigneurs et baigneuses, pour donner des chloramines ou des composés encore appelés « chlore combiné ». D’où la douche savonnée et le shampoing fortement recommandés en amont. Ces chloramines sont lacrymogènes, d’où la sensation d’avoir les yeux qui piquent, et ont une forte odeur attribuée par erreur « au chlore ». La consommation de ClOH par ces composés diminue la quantité de ClOH disponible pour éliminer les microroganismes. Si c’est le cas, il faut donc augmenter la concentration en acide hypochloreux.
Pour éliminer les chloramines il est nécessaire d’aérer et de renouveler partiellement l’eau de la piscine.
Le traitement par électrolyse
Il existe un autre mode de traitement des eaux de piscine, vendu sous les noms de « piscine au sel » ou « électrolyse au sel » ou « désinfection au sel ». Ce procédé est souvent présenté comme « plus écologique que le chlore » ou « traitement naturel donc plus écologique ». On lit aussi que ce procédé n’utilise pas de « chlore chimique » mais du « chlore naturel » !
Alors tout d’abord soyons clair, ce n’est pas le sel qui désinfecte l’eau de la piscine comme pourraient le faire croire certaines publicités, c’est toujours l’acide hypochloreux ClOH ou « chlore actif ». Et bien sûr c’est la même molécule chimique que celle obtenue avec les « galets de chlore ».
Comment ça marche ?
On introduit 3 à 6 g de chlorure de sodium (vii), NaCl, par litre d’eau de la piscine. Cette concentration est environ 6 à 11 fois moins concentrée que celle de l’eau de mer.
Un électrolyseur est un appareil présentant une cellule d’électrolyse comportant deux plaques en titane (ce sont les électrodes) et un système électrique permettant de créer une différence de potentiel constante (comme un générateur de courant continu). L'eau salée de la piscine est alors pompée à travers le système de filtration et acheminée jusqu'à la cellule d'électrolyse après être passée par les sondes d’analyses, le surpresseur et le réchauffeur. On crée une différence de potentiel (basse tension) entre les 2 électrodes ce qui provoque le passage d’un courant électrique qui va engendrer une réaction chimique à chacune des électrodes.
À l’anode il y a l’oxydation des ions chlorure en acide hypochloreux (viii). On a donc créé in situ le même composé qu’avec les « galets lents et chocs ». Il a bien sûr les mêmes propriétés de désinfection et d’élimination des microorganismes et des algues.
À la cathode, l’eau est réduite en dihydrogène (ix). Ce dihydrogène est entrainé dans le flux (on peut observer des bulles dans l’eau à proximité de la cellule d’électrolyse).
Donc l’électrolyse de l’eau salée a pour réaction globale : 2 H2O + Cl- → ClOH + H2 + OH-.
La réaction globale faisant apparaitre globalement des ions OH-, il est toujours indispensable, de contrôler le pH. Aussi les installations sont souvent proposées équipées d’un régulateur automatique de pH utilisant de l’acide sulfurique.
Lors de la réaction de ClOH sur les microorganismes, il est réduit en chlorure, Cl-, ce qui régénère le sel. C'est ainsi un cycle fermé.
Il faut toutefois surveiller régulièrement la concentration en sel et l’ajuster en cas de dilution par la pluie ou si l’eau de la piscine a été renouvelée ou s’il y a formation de chloramines qui consomment ClOH ce qui casse en partie ce cycle.
Les rayons ultraviolets (UV) provoquant une destruction photochimique de ClOH selon 2 ClOH → O2 + 2 H+ + 2 Cl-, cela rend plus difficile de maintenir le taux de « chlore actif » dans une piscine en plein air. Il faut donc aussi adapter la production par électrolyse au fait que la piscine soit couverte ou non.
L’état des électrodes joue un rôle important sur l’efficacité de la production de ClOH. En particulier leur durée de vie sera affectée si l’eau est très calcaire (ou dite « dure »). Les électrodes sont parfois proposées avec inversion de polarité possible pour alterner leur rôle d’anode ou de cathode et empêcher des dépôts de tartre (calcaire CaCO3).
Enfin le sel favorise la corrosion des installations, ce qui est à prendre en compte dans le coût d’entretien.
Françoise Brénon
(i) Le nom « acide trichloroisocyanurique » est impropre car ce n’est pas un acide. Son nom officiel est le 1,3,5-trichloro-1,3,5-triazinane-2,4,6-trione). Les formules développées sont :
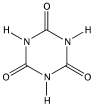
(ii) L’acide iso cyanurique a pour formule développée
(iii) L'acide cyanurique est classé comme « essentiellement non toxique ». Seule donnée sur la toxicité de l’acide isocyanurique : néphrotoxique chez l’animal si ingéré en grande quantité https://reptox.cnesst.gouv.qc.ca/Pages/fiche-complete.aspx?no_produit=11965
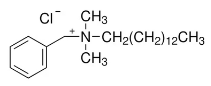
(iv) Exemple : Le chlorure de benzalkonium est un mélange de chlorures d’alkylbenzyldiméthylammonium, de formule générale [C6H5-N+(CH3)2CH2 R] Cl-, R représentant des radicaux « alkyl » de C8 à C18. Il est généralement répertorié dans la
littérature sous le numéro CAS n° 8001-54-5.
Exemple du plus couramment employé :
(v) Selon la réaction ClOH + Cl- + H+ → Cl2 + H2O. le dichlore formé est un gaz très toxique.
(vi) En effet si les particules sont très fines (< 20-40 µm) elles ne sont pas éliminées par le filtre à sable. Le phénomène en présence de sel d’aluminium est appelé floculation. Les ions Al3+ donnent un hydroxyde hydraté colloïdal Al(OH)3, x(H2O) agrégeant les particules en suspension, facilitant une filtration ultérieure.
(vii) Se reporter sur la notice du constructeur de l’appareil. Et on peut regarder des conseils en ligne.
(viii) Selon Cl- + H2O → ClOH + H+ + 2 électrons
(ix) Selon 2 H2O + 2 électrons → H2 + 2 OH-
Pour en savoir plus
[1] L'eau de Javel : sa chimie et son action biochimique, G. Durliat, J.L. Vignes et J.N. Joffin. BUP n° 792 (1997) pp. 451-469 et tout particulièrement pages 462-464 où est expliqué le rôle du pH et le pouvoir bactéricide de l’acide hypochloreux supérieur à celui des ions hypochlorite.
[2] Le traitement des eaux de piscine, collection Techno, Nathan (1987)
[3] Guide-piscine 2015, SIET, guide de bonnes pratiques, issu de travaux menés par l'ensemble des professionnels du traitement et de l'analyse des eaux de piscines. Concerne plus particulièrement les piscines collectives.
[4] Pour les piscines avec électrolyseurs on peut consulter les notices des constructeurs. Par exemple Distripool, ou Sterilor ou Dytech…
Crédit illustration : OceanProd / Adobe Stock
