L’eau acheminée aux soldats du front était le lieu de prolifération de nombreux micro-organismes pathogènes sources de dysenteries et de la typhoïde. Et après les premières attaques aux gaz, l’état-major interdit formellement de boire l’eau qui se trouve sur le front car les gaz empoisonnent les eaux stagnantes.
Comment éliminer les micro-organismes pathogènes présents dans l’eau ?
Les méthodes ont évolué vers plus d’efficacité tout au long du conflit et diffèrent selon que l’on dispose d’eau en containers ou d’eau apportée directement et continûment par canalisation.
Pour l’eau fournie en containers le traitement se fait à l’iode avec 3 comprimés : 1 bleu, 1 blanc et 1 rouge. Patriote jusque dans le traitement de l’eau !
C’est en juillet 1902 que le pharmacien Auguste Georges et le médecin Villard [1] [2] décrivent une méthode d’épuration des eaux de boisson dans la revue de médecine et de pharmacie militaire. Les soldats disposent de 3 comprimés (i) :
- Un comprimé bleu contenait de l’iodure et de l’iodate de potassium ainsi que du bleu de méthylène
- Un comprimé blanc contenait du thiosulfate de sodium (ancien nom « hyposulfite de soude »)
- Un comprimé rouge contenait de l’acide tannique
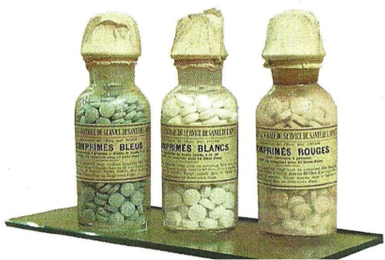

Comprimés tricolores (Musée du Service de Santé des Armées au Val-de-Grâce) source [2] ;
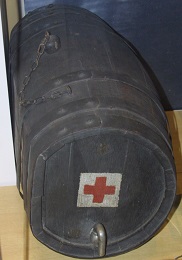
Tonnelet eau, Comprimés blancs et mode d'emploi (Photos F. Brénon au musée du Service de Santé des Armées au Val-de-Grâce)
Le mode d’emploi était le suivant : « Dissoudre 1 comprimé rouge avec 1 comprimé bleu dans ½ verre d’eau. Verser le liquide obtenu dans 10 L d’eau à traiter. Agiter. Attendre 10 min. Dissoudre 1 comprimé blanc dans un ½ verre d’eau. Verser cette solution dans les 10 L d’eau traités ».
Le comprimé bleu et le rouge dans l’eau engendraient du diiode, bactéricide et virulicide. Après avoir laissé agir, le comprimé blanc éliminait l’excès de diiode.
Plus en détail, les réactions mises en jeu et l’épuration étaient basées sur le principe suivant : le mélange d’iodure (I-) et d’iodate (IO3-) en présence d’acide (ici l’acide tannique) conduit à former du diiode (I2) dans le 1er récipient, selon la réaction :
IO3- + 5 I- + 6 H+ → 3 I2 + 3 H2O
Les proportions permettent de former une grande quantité de diiode.
L’agitation et le temps d’attente ont pour objet de faire réagir le diiode sur les microorganismes à éliminer.
Une fois l’action « d’épuration » par le diiode terminée, il faut éliminer l’excès de diiode restant. C’est le rôle du comprimé blanc qui permet de réaliser la réaction :
I2 + 2 S2O32- → S4O62- + 2 I-
Cette eau avait toutefois un gout iodé peu agréable.
Notons que le bleu de méthylène est à la fois un colorant et un bactéricide, l’acide tannique est un polyphénol de formule brute C76H52O46 et a aussi des propriétés astringentes et anti-diarrhéiques.
Traitement par les ions hypochlorite
Les ions hypochlorite ClO- sont disponibles :
- soit sous forme de comprimés d’hypochlorite de calcium [Ca(ClO)2], stables et faciles d’emploi pour des usages ponctuels
- soit présents dans l’eau de Javel, solution aqueuse basique de chlorure et d’hypochlorite de sodium, moins stable et plus délicate à utiliser.
L’eau de Javel tire son nom du village de Javel à l’ouest de Paris où elle a été fabriquée de 1784 à 1889. Elle a été utilisée d’abord pour ses propriétés de blanchiment du linge découvertes par Claude-Louis Berthollet (1748-1822) et puis pour ses propriétés désinfectantes en solution diluée étudiées tout particulièrement par Antoine-Germain Labarraque (1777-1850). L’eau de Javel est efficace pour lutter contre la propagation des maladies telles que la typhoïde et le choléra propagées par de l’eau contaminée.
On a montré depuis que l’eau de Javel est à la fois bactéricide et virulicide, propriétés dues aux ions hypochlorite et l’acide hypochloreux [3] [4].
À partir de 1915 le médecin Vincent et le pharmacien C. Gaillard [2] mettent au point une formule de comprimés d’hypochlorite de calcium et de sodium pour purifier l’eau de boisson.
En 1916, le service de santé décide de la javellisation de l’eau, traitement antimicrobien utilisant de l’eau de Javel. Deux méthodes sont possibles :
- LA JAVELLISATION : la quantité d’eau de Javel à ajouter est fonction de la contamination. Les doses sont de 1 à 5 mg de chlore actif (ii) par litre. Si l’eau était alors dépourvue de microorganismes pathogènes, son goût fort en chlore la rendait très désagréable à boire.
- LA VERDUNISATION [3] [4] [5] : le terme « verdunisation » provient de la Première Guerre mondiale au cours de laquelle cette technique a été utilisée à grande échelle pour désinfecter l’eau consommée par les « Poilus » de Verdun.
En effet, lors de la bataille de Verdun, l'Armée française, encerclée, ne disposait plus d'eau potable. Le commandant du Génie Philippe Buneau-Varilla (iii), en 1916 à Verdun, réussit à capter et à acheminer l'eau de la Meuse au moyen de puits, de pompes et de tuyaux jusqu’aux tranchées. Il mit au point un procédé automatique de potabilisation de cette eau en faisant injecter de l’eau de javel diluée juste à l'entrée des pompes centrifuges. Ce procédé préconise des doses d’eau de Javel de dix à cinquante fois plus faibles que la javellisation (de l’ordre de 0,1 mg de chlore actif par litre). Cette eau avait un bien meilleur goût que celle ayant subi une javellisation.
La différence dans l’efficacité vient du protocole : dans ce procédé, l’addition de l’eau de Javel est réalisée lentement avec un brassage vigoureux et prolongé. Ces conditions favorisent la dissolution du dioxyde de carbone contenu dans l’air, ce qui abaisse le pH et favorise le passage de l’ion hypochlorite à la forme acide hypochloreux, HClO, qui est plus bactéricide (iv) [3].
Notes
(i) La composition des comprimés et le mode d’emploi sont indiqués sur les étiquettes des flacons présentées au musée du Service de santé des armées du Val de Grâce (Paris). Les réactions chimiques proposées par F. Brénon en découlent.
(ii) Que signifie l’expression eau de Javel ou chlorure de chaux « à Y grammes en chlore actif » ? L’eau de Javel comme le chlorure de chaux contiennent des ions chlorure, Cl-, et hypochlorite, ClO-, en mélange équimolaire. L’ajout d’un acide fait passer ClO- à l’état d’acide hypochloreux HClO. Et si le milieu devient très acide la réaction de HClO sur les ions Cl- provoque un dégagement de dichlore Cl2 selon la réaction :
(iii) Philippe Buneau-Varilla (1859–1940) était ingénieur polytechnicien. Le procédé de verdunisation qu’il a mis au point en 1916 a été utilisé par la suite dans une cinquantaine d’établissements publics industriels ou miniers et dans plus d’une centaine de villes.
(iv) Ph. Buneau-Varilla a également proposé une action des UV dans la purification de l’eau [6].
Bibliographie
[1] L’épuration de l’eau potable en campagne - Archives de médecine et de pharmacie militaire (juillet 1902) p. 30 à 33 – BnF Gallica
[2] Histoire des comprimés pharmaceutiques en France, des origines au début du XXème siècle, André Frogerais (2013) p. 17 à 20. HAL : hal-00787009v4
[3] L'eau de Javel : sa chimie et son action biochimique, G. Durliat, J.L. Vignes et J.N. Joffin, BUP n° 792 (1997) p. 451 à 469 et tout particulièrement page 464 où est expliqué le rôle du pH et le pouvoir bactéricide de l’acide hypochloreux.
[4] Site internet de la FAO sur les rôles des composés chlorés et iodés : L’hygiène dans l’industrie agroalimentaire . Dans cette ressource il faut toutefois corriger la réaction.
L'hypochlorite de sodium s'obtient suivant la réaction théorique suivante :2 NaOH + 2 Cl → NaOCl + NaCl + H2O
par 2 NaOH + Cl2 →NaOCl + NaCl + H2O
[5] Ph. Bunau-Varilla, Guide pratique et théorique de la Verdunisation, Paris, J-B. Baillière (1930)
[6] Quelques documents sur la verdunisation des eaux , Ph. Buneau-Varilla, p. 40. BnF Gallica
[7] Bunau-Varilla et-la-verdunisation, article de La dépêche (1926)
Crédits illustrations
- Comprimés tricolores (Musée du Service de Santé des Armées au Val-de-Grâce) source [2] ;
- Tonnelet eau, Comprimés blancs et mode d'emploi (Photos F. Brénon au musée du Service de Santé des Armées au Val-de-Grâce)
- Couverture du livre Quelques documents sur la verdunisation des eaux, Ph. Buneau-Varilla, bibliothèque Exército Portugal
Petrus Jacobus Kipp (1808-1864) était né à Utrecht où il avait étudié la pharmacie. En 1830 il s’était installé à Delft comme pharmacien et marchand de produits chimiques et d’instruments de laboratoire. Le commerce d’appareils de laboratoire était ancien à Delft, celui des frères Bayens occupait 14 ouvriers vers 1820. En 1850 Kipp proposait un catalogue de 734 articles.
Il avait inventé un appareil en verre pour produire de petites quantités de gaz avec la possibilité d’interrompre la production à son gré. On l’utilisait dans les établissements d’enseignement du 20e siècle pendant les séances de manipulation que nous appelions familièrement « pêche aux ions ». Il s’agissait de reconnaître la nature des cations dans une solution aqueuse saline. L’appareil est composé de deux parties : une base de deux sphères superposées communicantes munies chacune d’un orifice latéral, et une ampoule qui pénètre dans les deux sphères en s’introduisant par le haut. Dans l’orifice latéral de la partie basse de l’appareil on introduisait du sulfure de fer (pyrite) et on rebouchait l’orifice, l’ampoule contenait une solution d’acide (chlorhydrique ou sulfurique) qui pouvait s’écouler sur la pyrite. Leur réaction produisait du sulfure d’hydrogène gazeux qui se répandait dans la partie sphérique et qui pouvait s’échapper par l’orifice latéral ouvert de la sphère supérieure. Celui-ci était muni d’un tube à dégagement qu’on fermait ou ouvrait à volonté. Par ce tube on envoyait le gaz barbotter dans la solution à analyser.
Quand la solution ne contenait qu’un sel dessous, et si l’addition d’acide chlorhydrique ne donnait pas de précipité, [signalant la présence de plomb, argent, ou mercure (I)], on faisait barboter H2S dans la solution légèrement acidifiée et chauffée vers 70 °C. H2S précipitait certains cations sous forme de sulfures. On filtrait, on lavait le précipité et on en mettait un peu dans un tube avec une solution de sulfure d’ammonium. S’il se solubilisait on identifiait le cation présent dans la liqueur primitive par la couleur de son sulfure, rouge orange pour l’antimoine, jaune serin (et soluble dans l’ammoniaque) pour l’arsenic, jaune sale (et insoluble dans l’ammoniaque) pour l’étain (IV), chocolat pour l’étain (II), brun noir pour l’or. Si le précipité de sulfure était insoluble dans la solution de sulfure d’ammonium et s’il était jaune et soluble dans l’acide nitrique, c’était du cadmium. S’il était noir, ce pouvait être du cuivre, du bismuth ou du mercure (II). La couleur du précipité donné par la liqueur primitive additionnée de potasse permettait de distinguer le cuivre (bleue), du bismuth (blanc), et du mercure (II) (jaune).
À cause de l’odeur nauséabonde et de la toxicité de l’hydrogène sulfuré, l’appareil était maintenu sous la hotte.
L’appareil de Kipp est une page de l’instrumentation pour la chimie minérale. On procède aujourd’hui avec une sensibilité incomparablement meilleure par des méthodes physiques quantitative (spectroscopie d’absorption atomique) pour analyser des produits minéraux.
Dans un autre usage le dispositif permet de fabriquer des gaz : le dispositif pouvait servir à produire du dioxyde de carbone en utilisant du marbre au lieu de pyrite, et du dihydrogène en utilisant du fer.


Orgue de pharmacien chimiste
Pour en savoir plus
Le pharmacien P.-J. Kipp (1808-1864) et son appareil, H.-A.-M. Snelders, Revue d’histoire de la pharmacie 212 (1972) pp. 3-12
Crédits illustrations :
- Appareil de Kipp. MNHN, photo : B. Bodo ; planche Encyclopédie Chimique, E. Fremy (1882)
- Orgue de pharmacien-chimiste, WIkimedia Commons, licence CC0
Agatha Christie, née à Torquay en Angleterre le 15 septembre 1890, a obtenu un diplôme en pharmacie le 30 avril 1917 après avoir servi comme assistante chimiste dans un hôpital militaire pendant la Première Guerre mondiale. C’est pourquoi dans de nombreux romans policiers, elle utilise des poisons végétaux qui entraînent la mort. Les produits pris à faible dose servent souvent à soulager le malade et sont considérés comme des médicaments mais si la dose est supérieure, le produit peut devenir mortel. Ces produits proviennent de plantes qui, elles aussi, sont dangereuses dans les jardins.
Dans le roman La maison du péril, certains protagonistes consomment de la cocaïne. La cocaïne est obtenue à partir de l’Erythroxylum coca. C’est un arbrisseau qui pousse dans diverses régions d’Amérique du Sud, en Indonésie et dans l’Est africain. La formule chimique de la cocaïne est C17H21NO4 et sa formule développée est la suivante :
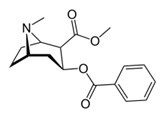
Elle est classifiée comme stupéfiant par la Convention unique sur les stupéfiants de 1961 de l'ONU. Elle est illégale dans presque tous les pays, dépénalisée en République tchèque et au Portugal. La feuille de coca est utilisée depuis très longtemps par les indigènes des plateaux andins. La feuille de coca est mâchée ou prise en infusion pour les aider à résister à la fatigue et à l'altitude. Sous cette forme, la coca a un léger effet stimulant, comparable à celui de la caféine. Une feuille de coca contient 0,5% de cocaïne. Dès 1870, on voit apparaître la consommation populaire de vin dans lequel sont infusées préalablement des feuilles de coca. En 1871, le marché est dominé par une marque restée célèbre : le « vin Mariani », boisson tonique française du nom de Ange François Mariani dit Angelo Mariani (1838-1914), préparateur en pharmacie qui a fait macérer des feuilles de coca dans du vin de Bordeaux et a eu l'idée de commercialiser ce vin.
Quant au Coca-Cola, il est créé en 1886 par un pharmacien John Pemberton (1831-1888) pour une boisson à base de coca. De nos jours il n’y a plus de cocaïne dans le Coca-Cola.
Les décès dus à la cocaïne dépendent de facteurs liés à la santé (hypertension, insuffisance respiratoire, asthme, diabète), à une overdose (dose létale 1,2g) ou à une consommation associée à un mélange d’autres substances (tabac, alcool…).


Agatha Christie / Erythroxylum coca
Pour en savoir plus
- Dame Agatha Christie pharmacien : Eunice Bonow Bardell, Dame Agatha's Dispensary, L. Coignerai-Devillers, Revue d’Histoire de la Pharmacie (1984) pp. 199-200
- La coca, la cocaïne et la cocaïnomanie : Symposium Geschiedenis van de Cocaïne, Histoire de la Cocaïne, Brussel, 20 april 1991, P. Julien, Revue d'Histoire de la Pharmacie (1992) pp. 345-346
- W. Golden Mortimer, De la coca à la cocaïne, Z. Domic, Annales. Histoire, Sciences Sociales (1995) pp. 701-711
- À la poursuite du Vin Mariani…, W.H. Helsan, Revue d'Histoire de la Pharmacie (1988) pp. 167-170
- Mariani et le vin de coca, W.H. Helsan, Revue d'Histoire de la Pharmacie (1980) 247 pp. 227-234
- Information et prévention sur les risques liés à la cocaïne, MILDECA (Mission interministérielle de lutte contre les drogues et les conduites addictives ) drogues.gouv.fr
Crédits illustrations :
- Erythroxylum coca, Plantes médicinales de Köhler, Wikimedia Commons, domain public
- By Agatha Christie plaque -Torre Abbey.jpg: Violetrigaderivative work: F l a n k e r - Agatha Christie plaque -Torre Abbey.jpg, Wikimedia Commons, licence CC BY-SA 3.0
Les pastilles de Vichy ont été inventées par Jean-Pierre-Joseph d’Arcet (1777-1844). Son père, Jean d’Arcet (1724-1801), après avoir été secrétaire de Montesquieu (1689-1755), avait épousé la fille de François Guillaume Rouelle (1703-1770), était devenu professeur au Collège de France et membre de l’Académie des sciences. Joseph Louis Proust (1754-1826) a été son correspondant. Jean-Pierre Joseph a créé les premières fabriques de soude et de potasse artificielles, par le procédé Leblanc dans la diffusion duquel son père avait été impliqué, et d’alun, associé au fils d’Antoine Chaptal (1756-1832).
En 1826 il publiait une Note sur la préparation et l’usage des pastilles alcalines digestives contenant du bi-carbonate de soude dans les Annales de chimie et de physique (t. 31, p. 58-67). Souffrant de douleurs gastriques il prenait quotidiennement des pastilles de magnésie. Il craignait que cette substance alkaline entraînât la formation de calculs urinaires et leur préféra des pastilles de carbonate de sodium. En 1824 il fit un premier séjour aux eaux de Vichy et “sachant que le bicarbonate de soude (hydrogénocarbonate de sodium) est le principe actif de ces eaux minérales et que ce sel a une saveur beaucoup moins alkaline que celle du carbonate de soude” il pensa à substituer le bicarbonate au carbonate et donna sa recette au pharmacien Regnauld qui mit le produit dans le commerce dès 1825.
Sa recette était la suivante :
- Hydrogénocarbonate de sodium 5 g
- Sucre blanc en poudre fine 95 g
- Mucilage de gomme adragante préparée à l’eau
- Quelques gouttes de menthe pure et récemment préparée
Elle fut insérée dans le Codex en 1837 (p. 420) avec 32 g d’hydrogénocarbonate pour 600 g de sucre sous le nom de pastilles de Vichy ou de Darcet. Le procédé de Darcet consistait à saturer les carbonates des eaux de Vichy par le gaz des sources (CO2). En 1854 Jules Lefort, futur président de la Société de pharmacie de Paris indiqua à François Bru, locataire de la source Lardy, les moyens de séparer les carbonates alcalinoterreux, puis de concentrer la solution jusqu’à une densité définie et de laisser cristalliser par refroidissement le carbonate de sodium facile à bicarbonater. Un contrôle officiel de la fabrication ne fut institué qu’en 1857 par arrêté du Ministère de l’agriculture.

https://bibliotheques.mnhn.fr/medias/doc/EXPLOITATION/IFD/MNHN_PO1417/,
Wikimedia Commons , Domaine public
Pour en savoir plus
- Note sur la Préparation et l’Usage des Pastilles alcalines digestives contenant du bi-carbonate de soude, Jean-Pierre-Joseph d’Arcet, Annales de chimie et de physique, 1826 (T31) p.58
Au début du XXe siècle, deux pays ont construit un institut du radium, l’Autriche-Hongrie et la France. Celui de Vienne et celui de Paris ont eu de nombreux contacts. Dans les deux instituts, les femmes ont joué un grand rôle et ont été considérées. Elles ont quelquefois, à un moment donné, travaillé aussi bien à Vienne qu’à Paris.
À Vienne, Berta Karlik, née le 14 janvier 1904, soutient une thèse en physique nucléaire en 1927 sous la direction de Stefan Meyer (1872-1949) et de Hans Thirring (1888-1976). Puis elle enseigne les mathématiques et la physique dans le lycée où elle a fait ses études. Elle bénéficie d’une bourse en 1930 et peut se rendre à Londres afin de se perfectionner en cristallographie auprès de Sir William Bragg (1890-1971). Elle vient aussi à Paris et rencontre Marie Curie (1867-1934). À son retour à Vienne, elle entre à l’Institut du radium en 1931. Les femmes représentent 38% de l’effectif, Berta Karlik y fera toute sa carrière.
Avec Karl Przibram (1878-1973) et le suédois Hans Pettersson (1888-1966), elle travaille sur la synthèse de la fluorescence bleue de la fluorine, la bande bleue de la fluorescence est due à l’europium, élément chimique classé dans la famille des terres rares. Ce travail, comme d’autres sont indiqués, en France, dans la Revue générale des sciences pures et appliquées.
En 1933, elle reçoit avec Elisabeth Rona (1890-1981) le prix Haitinger de l’Académie autrichienne des sciences pour des recherches dans le domaine de la luminescence. Lorsque Pettersson quitte Vienne et retourne à Uppsala pour diriger l’institut océanographique ainsi que la station hydrographique de Bornö située dans le sud de la Suède près du Gullmarfjord, Berta Karlik comme Elisabeth Rona se rendront en Suède afin d’étudier la radioactivité de l’eau de mer et sa teneur maximale en éléments radioactifs.
Le 12 mars 1938, l’Allemagne annexe l’Autriche, les chercheurs juifs sont chassés de l’Institut. Berta Karlik peut continuer ses recherches car elle n’est pas juive.
Berta Karlik et Traude Cless-Bernert (1915-1998) mettent en évidence l’existence de l’astate naturel en 1944 alors qu’Emilio Segrè (1905-1989), Date R. Corson (1914-2012) et K.R. Mac Kenzie l’avaient obtenu, en 1940, au laboratoire en bombardant du bismuth avec des particules alpha (α) accélérées. Cet élément naturel existe en très faible quantité dans la nature, il est radioactif et instable, c’est un des produits de la désintégration de l’uranium, du thorium et du francium, dont un de ses isotopes est utilisé en radiothérapie. Pour cette nouvelle découverte, elle recevra un second prix Haitinger seule cette fois-ci en 1947.
Suite à la découverte de l’astate, elle devient directrice provisoire de l’Institut en 1945 à la place de Stefan Meyer qui est destitué comme juif et en 1947, lorsqu’il prend sa retraite, elle lui succède et conservera le poste jusqu’à sa propre retraite en 1974. À l’université de Vienne, elle est professeur associé en 1950 et en 1956, elle est la première femme professeur titulaire. Elle devient membre correspondant de l’Académie autrichienne des sciences dès 1954 et la première femme membre de cette institution en 1973.
Berta Karlik est nommée à la commission du bureau du chancelier fédéral comme conseiller sur les questions concernant l’énergie nucléaire. Les Nations-Unies organisent deux conférences à Genève du 8 au 20 août 1955 puis du 1er au 13 septembre 1958 sur les applications pacifiques de l’énergie nucléaire et elle est le représentant officiel de l’Autriche. En 1958, le congrès international porte le nom « L’atome pour la paix ».
Berta Karlik participe aussi à la commission pour la mesure des rayonnements ionisants du bureau international des poids et mesures à Sèvres. En 1958, il est décidé de créer un comité consultatif pour les étalons de mesure des radiations ionisantes. Elle est experte auprès du comité consultatif et chargée du groupe de travail qui doit faire des propositions sur l’étalon de radioactivité. C’est l’étalon international conservé à l’Institut du radium à Paris qui sera déplacé vers le bureau international des poids et mesures.
En 1974 elle prend sa retraite mais continue à travailler à l’institut. Elle meurt le 4 février 1990.
Retracer les recherches et la vie de Berta Karlik permet de décrire les premiers temps de la radioactivité et le rôle que les femmes y ont joué.

Monument à la physicienne Berta Karlik (1904-1990) dans la cour de l'Université de Vienne (artiste : Thomas Baumann).
Source : Sandra Folie, travail personnel, Wikimedia Commons, licence CC BY-SA 4.0
Pour en savoir plus
- Synthèse de la fluorescence bleue de la fluorine, H. Haberlandt, K. Przibram, Karlik, Revue générale des sciences pures et appliquées, Paris (février 1934) n°4, T45, p.127
- Sur la clarté relative des scintillations des rayons H de différents parcours, E. Kara-Michailova, B. Karlik, Revue générale des sciences pures et appliquées, Paris (1930) t.41, p.93
- La radioactivité de l’eau de mer, S. Veil, Revue scientifique, Paris (janvier 1939) A77, N1, p.329
- Académie des sciences de Vienne 1 janvier 1933 p. 382 et 1er janvier 1934 p. 127
- Les femmes et l’Institut du radium de Vienne, C. Paquot-Marchal, BUP, n° 1036 (juil. aout sept. 2021), p. 767-777
La Fondation de la maison de la Chimie s’est associée à la manifestation culturelle et scientifique organisée par la ville du Havre « Sur les épaules des géants » autour du thème de la lumière.
Nous vous proposons la lecture de ce petit dictionnaire Mediachimique qui suscitera sans aucun doute votre curiosité et vous donnera envie d’en savoir plus sur les liens de la chimie et la lumière.
L’absorption de lumière permet d’effectuer certaines transformations chimiques tandis que d’autres peuvent s’accompagner d’une émission de lumière. Nous allons voir, à travers les deux exemples proposés, que l’interaction entre la lumière et la matière permet la conversion d’énergie chimique en énergie de rayonnement et réciproquement.
Partie A : La chimiluminescence. Partie B : La photosynthèse, source d’inspiration pour les chimistes
Parties des programmes de physique-chimie associées
- Programme de physique-chimie de la seconde générale et technologique. Partie « Constitution et transformations de la matière »
- Programme de physique-chimie de la première générale. Parties « Constitution et transformations de la matière » et « ondes et signaux »
- Programme de la spécialité physique-chimie de terminale générale. Partie « Constitution et transformations de la matière »
- Programme de physique-chimie de première STI2D. Partie « Matière et matériaux » / Propriétés des matériaux et organisation de la matière
Pour lutter contre le changement climatique, diminuer la consommation d’énergie fossile est nécessaire. Cette diminution accroit les besoins en ressources minérales, de nombreux produits présents dans notre quotidien mettant en jeu des matières premières qualifiées stratégiques. La dépendance de l’Europe aux importations de ces matières premières a mis en évidence, dans un contexte géopolitique et économique incertain, sa vulnérabilité face aux enjeux des transitions écologique et numérique. Une sécurisation de l’approvisionnement en métaux considérés comme essentiels s’impose à l’Europe comme à la France. Comment la France peut-elle relever les défis stratégiques pour garantir un accès durable, sûr et écoresponsable à ces ressources ?
Parties des programmes de physique-chimie associées
- Programme de physique-chimie de seconde générale et technologique – Constitution de la matièrede l’échelle macroscopique à l’échelle microscopique, A) Description et caractérisation de la matière à l’échelle macroscopique
- Programme de sciences physiques et chimiques en laboratoire de première STL – Chimie et développement durable, Sécurité et environnement
- Programme de physique-chimie et mathématiques de première STI2D – Matière et matériaux, Propriétés des matériaux et organisation de la matière
- Programme d’innovation technologique et d’ingénierie et développement durable de première et d’ingénierie, innovation et développement durable de terminale STI2D – 1. Principes de conception des produits et développement durable, 1,5. Approche environnemental
- Programme d’enseignement scientifique de terminale générale – Thème 2 : Le futur des énergies
Le colloque « Chimie et sports en cette année olympique et paralympique » du 7 février 2024, a permis de faire le point sur quelques aspects liés à la performance sportive dépendant des facteurs physiques, psychologiques et techniques. Le monde de la recherche est pleinement mobilisé depuis des décennies pour améliorer les matériaux et équipements sportifs qu’il soit amateur ou professionnel. Lancé en 2018 par quinze grandes écoles et regroupant 60 chercheurs, le programme de recherche Sciences2024® s’est mis au service des équipes de France en vue des Jeux Olympiques et Paralympiques de Paris 2024. Mais tout ceci ne se limite pas aux matériels du sportif, car notre corps est une « véritable usine chimique mobile » dans laquelle les relations entre la performance sportive, la biologie et la santé sont étroites. Mais si la chimie de notre corps peut apporter le meilleur, certains excès peuvent apporter le pire et la traque aux molécules dopantes ou simplement nocives est un défi permanent...
Parties des programmes de physique-chimie associées :
- Programmes de physique-chimie et de mathématiques de première STI2D et terminale STI2D – Partie « Matière et matériaux »
- Programmes de Spécialité de physique-chimie pour la santé de première ST2S – Parties « Prévenir et sécuriser » et « Analyser et diagnostiquer »
- Programme de spécialité de biologie et physiopathologie humaines de première ST2S – Parties : « Appareil digestif et nutrition : Comment les aliments sont-ils transformés pour être assimilés par l’organisme ? En quoi l’alimentation est-elle un facteur de développement et de santé ? »
- Programme de la spécialité physique-chimie de terminale générale – Partie « Constitution et transformations de la matière », 4. Élaborer des stratégies en synthèse organique
La dynastie des Becquerel et leur intérêt pour la phosphorescence
Antoine César Becquerel (1788-1878), fondateur de la dynastie des Becquerel au Muséum, a été nommé professeur titulaire de la chaire de Physique appliquée aux sciences naturelles, à sa création en 1838 à l’initiative de Joseph Gay-Lussac. Au cours d’un voyage à Venise, Antoine César avait observé que la nuit, la mer devenait phosphorescente et il a commencé à s’intéresser à ce phénomène.
Son fils Edmond Becquerel (1820-1891) a succédé à son père comme professeur en 1878. On lui doit la découverte de l’effet photovoltaïque (1839) et la réalisation de la première photographie en couleur représentant le spectre solaire sur plaque argentée (1848). Mais ses recherches ont principalement porté sur les différentes formes de luminescence (*), fluorescence et particulièrement la phosphorescence des sels d’uranium. Pour mesurer la durée de phosphorescence, il a inventé le phosphoroscope (1857), appareil permettant de mesurer le temps qu'il faut à un matériau phosphorescent pour cesser de briller après avoir été excité par de la lumière.
Enfin, Henri Becquerel (1852-1908), fils d’Edmond qui lui a succédé comme professeur en 1892, a porté un intérêt scientifique, entre autres sujets, à la phosphorescence de sels d’uranium. Tous ont été polytechniciens, sauf Edmond reçu à cette Ecole, mais qui a préféré travailler dans le laboratoire de son père. Tous ont été membres de l’Académie des sciences.
La découverte des rayons X par Röntgen et sa présentation par Henri Poincaré à l’Académie
En novembre 1895 Wilhelm Conrad Röntgen, professeur à l’université de Würzburg, découvrit les rayons X alors qu’il faisait fonctionner un tube de Crookes dans l'obscurité. Ayant placé ce tube dans l’obscurité, il observa une fluorescence sur un écran en papier recouvert de platinocyanure de baryum. Il a noté que cette fluorescence accompagne la production des rayons X et que si les rayons X ne sont pas visibles par l’œil, ils impressionnent les plaques photographiques, même protégées par du papier noir.
Peu de temps après, le 20 janvier 1896, Henri Poincaré présenta devant ses collègues de l’Académie des sciences, la découverte de Röntgen et attira l’attention d’Henri Becquerel dont il connaissait l’intérêt pour la phosphorescence des sels d’uranium, lui suggérant de voir si elle ne s’accompagnait pas de l’émission de rayons X.
La découverte des rayons uraniques d’Henri Becquerel
Après plusieurs expériences négatives avec différents corps phosphorescents, Becquerel a utilisé des cristaux de sulfate double d’uranyle et de potassium « qu’il avait préparé une quinzaine d’années avant ». Il les déposa sur une plaque photographique « Lumière » soigneusement enveloppée dans du papier noir pour la protéger de la lumière, puis exposa le dispositif plusieurs heures au soleil.
Ensuite, il développa la plaque et observa qu’elle est impressionnée, malgré sa protection par le papier noir. Il en déduisit que les sels d’uranium émettaient des rayons X après excitation par la lumière du soleil et présenta ce résultat à l’Académie dans une note le 24 février 1896 (1).
Puis, il voulut recommencer l’expérience, mais, pendant plusieurs jours, le soleil ne se montra pas. Dans l’attente de son retour, il rangea le dispositif expérimental dans un tiroir à l’obscurité. Quand le 28 février le soleil revint, il reprit son expérience et prépara un nouveau dispositif. Mais il ne jeta pas le dispositif préparé auparavant, pensant que faute de soleil et donc de phosphorescence, la plaque ne serait pratiquement pas impressionnée. Il la développa normalement, et à sa grande surprise l’impression de la plaque restée dans le noir fut beaucoup plus intense que celle de la première expérience. Il en conclut que le sel d’uranium émettait donc spontanément des rayons pénétrants, qu’il ait été ou non exposé à la lumière du soleil et nomma ce rayonnement « rayons uraniques ». Il présenta ce nouveau résultat à l’Académie le 1er mars 1896 (2). C’était là, la découverte capitale d’Henri Becquerel, celle des « rayons uraniques », fruit du hasard dans un esprit préparé d’un expérimentateur rigoureux.
Pierre Curie et son frère Jacques (**), un autre élève de l’Ecole de Chimie d’Edmond Frémy au Muséum, réalisèrent un appareil (quartz-piézzo électrique) qui permettra de faire des recherches quantitatives sur les substances radioactives, les travaux de Becquerel étant purement qualitatifs. Cette possibilité a permis à Marie Curie de découvrir en 1898 dans la pechblende des substances plus radioactives que l’uranium : le polonium et le radium (3) (4). Le nom de « radioactivité » a été donné au phénomène par Marie Curie.
Pour leurs travaux sur la découverte de la radioactivité, le prix Nobel de physique de 1903 a été décerné à Henri Becquerel, Pierre Curie et Marie Curie.

Pierre et Marie Curie dans leur laboratoire parisien, avant 1907
Notes
* Les phénomènes de luminescence, fluorescence ou phosphorescence, apparaissent lorsqu’un corps absorbe la lumière visible ou ultraviolette, puis la réémet à une longueur d’onde plus grande (décalée vers la partie rouge du spectre). Les deux phénomènes de phosphorescence et fluorescence sont quasiment identiques. La différence est que le matériau phosphorescent continue d'émettre de la lumière dans le noir même si on arrête de l'éclairer. Après exposition à la lumière un matériau phosphorescent diffuse la lumière dans le noir alors qu’un matériau fluorescent n'émet pas de lumière dans l'obscurité, mais produit une couleur vive si on l'éclaire.
** Pierre Curie et Jacques, âgés de 21 et 25 ans, découvrent en 1880, la piézoélectricité. L’effet piézoélectrique est une propriété de certains cristaux, comme le quartz, d’émettre de petites quantités d’électricité lorsqu’ils sont comprimés ou étirés. En 1885, ils font construire un instrument pour leur laboratoire, qu’ils appellent tout simplement “quartz piézoélectrique”. Cet instrument, permet de faire des mesures quantitatives de la radioactivité d’échantillons. Cet instrument est introduit par Marie et Pierre Curie dès 1898 dans leur méthode de mesure de la radioactivité, appelée aujourd’hui « méthode Curie ». Lors de cette mesure, les deux scientifiques compensent la charge électrique inconnue produite par l’échantillon radioactif, avec la charge électrique connue générée par le quartz. La méthode de compensation leur permet de mesurer, en utilisant un électromètre à quadrant, des courants très faibles, de l’ordre de 10-13 ampères. Ces mesures, très précises, leur permettent de détecter dès 1898, dans les minerais d’uranium, la présence de quantités infimes de deux nouveaux éléments chimiques radioactifs : le polonium et le radium. « Pour mesurer les courants très faibles que l’on peut faire passer dans l’air ionisé par les rayons de l’uranium, j’avais à ma disposition une méthode excellente étudiée et appliquée par Pierre et Jacques Curie. » Marie Curie, Pierre Curie, 1923.
Bibliographie
1 - Henri Becquerel. Sur les radiations émises par phosphorescence. C.R. Acad. Sci. 122 (1896) p. 420-421.
2 - Henri Becquerel. Sur les radiations invisibles émises par les corps phosphorescents. C.R. Acad. Sci. 122 (1896) p. 501-503.
3 - Pierre Curie et Marie Curie, Sur une substance nouvelle radio-active (polonium), contenue dans la pechblende. C.R. Acad. Sci. 127 (1898) p.175-178.
4 - Pierre Curie, Marie Curie et Gustave Bémont, Sur une nouvelle substance fortement radio-active (radium), contenue dans la pechblende. C.R. Acad. Sci. 127 (1898) p. 1215-1217.
Illustration : Pierre et Marie Curie dans leur laboratoire parisien, avant 1907. Source : Wikimedia commons
