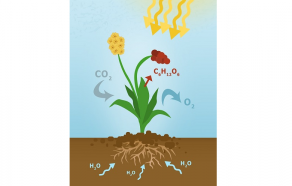
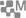Non le gaz carbonique n’est pas un polluant, chimistes et biochimistes répètent à l’envie : le CO2 c’est aussi la vie ! (1) En effet si le carbone est l’élément essentiel du monde vivant, couplé à deux oxygènes et caressant une feuille sous le soleil et en présence d’eau, il permet aux végétaux de produire des molécules organiques telles que les sucres et la cellulose, âmes de la biomasse. Cette réaction naturelle de la photosynthèse fascine depuis longtemps les chercheurs qui rêvent de la reproduire (2).
Depuis plus de vingt ans, l’imagination des électrochimistes a permis de belles avancées (3). Le schéma le plus efficient couple une cellule photovoltaïque (4) qui sous rayonnement solaire fournit des électrons à une cellule électrochimique qui oxyde l’eau à l’anode et réduit le CO2 à la cathode.
Plusieurs réalisations ont déjà vu le jour fournissant à partir du CO2 du CO, des alcools, des acides organiques et même du méthane. Les rendements ont été parfois très corrects et supérieurs à celui de la photosynthèse naturelle, mais ils nécessitent le plus souvent des matériaux peu abondants et coûteux - des semiconducteurs de type AsGa, des catalyseurs à base de métaux précieux (rhodium, iridium, platine…) - rendant ces cellules difficilement extrapolables à grande échelle.
Pour passer à une échelle industrielle, ces systèmes mimant la photosynthèse naturelle doivent remplir plusieurs conditions :
- une réduction catalytique efficace du CO2 avec des électrocatalyseurs ne comportant pas de métaux rares ou chers (5) ;
- un milieu électrolytique stable et de pH peu acide pour limiter la corrosion ;
- un design de cellule avec une répartition des compartiments anodiques et cathodiques optimales pour éviter les pertes ohmiques ;
- un couplage à un système photovoltaïque robuste et peu coûteux.
C’est ce qu’a réussi un groupe de chercheurs européens coordonné par le Laboratoire de Chimie des Processus Biologiques (LCPB) du Collège de France (*). Après des années de recherche ce groupe a mis au point un système comprenant :
- une cellule d’électrocatalyse optimisée avec une distance anode-cathode réduite permettant un courant stable sous une tension inférieure à 3V ;
- des solutions électrolytes peu corrosives comportant des concentrations stabilisantes de bicarbonate ou carbonate de cesium ;
- des matériaux d’électrodes à base de cuivre où à la cathode sont présentes des couches d’oxyde Cu2O et CuO (6), la dernière montrant une structure dendritique nanostructurée poreuse ;
- une cellule photovoltaïque originale constituée de pérovskite (7) de type CH3NH3 Pb I3-x Brx fabriquée simplement par multicouches fonctionnelles avec des éléments abondants.
En fonctionnement, sous un flux de gaz CO2, la réduction de ce gaz et l’oxydation de l’eau fournissent des mélanges d’hydrocarbures tels que C2H4, C2H6, et CO, H2 bases de la chimie organique. Le rendement calculé par rapport à CO2 est de 2,3% (plus élevé que les 1% de la photosynthèse naturelle). Ce qui est important à souligner est que ce nouveau procédé mêle au moins deux innovations :
- une cellule électrocatalytique utilisant un métal abondant et très utilisé le cuivre
- et un générateur photovoltaïque à base de pérovskite se fabriquant à température ordinaire par sérigraphie de multicouches de matériaux peu coûteux, dont la fabrication industrielle commence.
Bien sûr des études complémentaires de procédés sont à faire car la cellule fonctionne avec du dioxyde de carbone pur alors que dans l’atmosphère (8) il est dilué à 400 ppm. L’augmentation des surfaces de contact ou le captage et la concentration peuvent être des solutions futures pour le développement industriel (9). Alors on peut se mettre à rêver à une économie de carbone en cycle fermé, en imaginant que nos combustibles seraient issus du même dioxyde de carbone produit par leur combustion. Voilà une belle solution à l’épuisement des ressources carbonées fossiles.
Jean-Claude Bernier et Catherine Vialle
Mai 2019

Pour en savoir plus
(1) Le CO2, matière première de la vie (Chimie et … Junior)
(2) Que faire du CO2 ? De la chimie ! 1334
(3) Les nouvelles cellules solaires nanocristallines 242
(4) Le soleil comme source d’énergie – le photovoltaïque 268
(5) Énergie électrique et réduction du dioxyde de carbone : quels électrocatalyseurs ? 878
(6) Expérience de réduction de l’oxyde de cuivre II (The reduction of copper oxide) 987
(7) Cristaux, cristallographie et cristallochimie 934
(8) Atmosphère ! Atmosphère ! Alerte ! 1555
(9) Le dioxyde de carbone : enjeux énergétiques et industriels 875
(*) Low-cost high-efficiency system for solar-driven conversion of CO2 to hydrocarbons, Tran Ngoc Huan, Daniel Alves Dalla Corte, Sarah Lamaison, Dilan Karapinar, Lukas Lutz, Nicolas Menguy, Martin Foldyna, Silver-Hamill Turren-Cruz, Anders Hagfeldt, Federico Bella, Marc Fontecave, Victor Mougel, Proceedings of the National Academy of Sciences Mar 2019, 201815412
DOI: 10.1073/pnas.1815412116
Introduire l’histoire des sciences dans son enseignement c’est un moyen d’aborder autrement l’enseignement scientifique avec des conséquences positives tant sur la motivation des élèves que sur leur acquis. C’est aussi former des citoyens désireux et capables de s’impliquer dans les choix de société mettant la science en jeu.
Mediachimie a créé pour vous des vidéos passionnantes et riches d’informations. Vous trouverez ainsi une série d’anecdotes historiques relatives à la chimie, Les petites histoires de la chimie :
D’un point de vue pédagogique, ces animations sur l’histoire des sciences peuvent intervenir dans toutes les phases d’une séquence.
N’hésitez pas à les utiliser et si vous le souhaitez nous faire part de vous expériences pédagogiques.
Une mesure calorimétrique a pour but de déterminer des grandeurs thermodynamiques liées à un matériau ou à une transformation chimique ou physique grâce à la mesure d’une modification de la température du système considéré.
Au lycée, la transformation s’effectue dans un calorimètre adiabatique ou quasi-adiabatique (calorimètre de Berthelot, vase Dewar ou bouteille Thermos), enceinte calorifugée fermée pour laquelle on fait l’hypothèse qu’aucun transfert de chaleur ne s’effectue avec l’extérieur. L’application du premier principe de la thermodynamique permet d’accéder à des grandeurs thermodynamiques telles que les enthalpies de changement d’état, les capacités thermiques ou encore certaines enthalpies de réactions.
[…]
Lire la suite du Zoom sur la microcalorimétrie : du vase Dewar aux techniques de pointe
Dans le cadre de « l’Année de la chimie de l'école à l'université 2018-2019 » venez tester vos connaissances sur l’histoire du tableau de Mendeleïev et les symboles des éléments.
Retrouvez ici tous les quiz.
Vous pouvez également participer, pour les 150 ans du tableau périodique des éléments chimiques, au concours « Mendeleïev 2019 » organisé par l’Union des professeurs de physique et de chimie (UdPPC) dans les collèges et lycées.
Cela fait déjà presque six mois que deux trains à hydrogène Coradia iLint d’Alstom sont exploités commercialement en Allemagne sur la ligne Cuxhaven - Buxtehude de 100 km. La France se réveille à peine et un chargé de mission le député Benoit Simian a remis en novembre un rapport sur l’utilisation de tels trains pour les nombreuses petites lignes non électrifiées (1).
Vous avez tous sans doute emprunté des TER régionaux marchant au gazole avec des moteurs diesel, bruyants et dont les fumées noircissent les quais et halls des gares. Ce nouveau train franco-allemand est plus silencieux et n’émet que de la vapeur d’eau dans ses fumées. Il a été mis au point par le constructeur en 2016 grâce aux innovations menées par deux centres, celui de Salzgitter en Allemagne pour la partie électrique et celui de Tarbes en France pour la partie traction et moteurs.
Quelle est son originalité ? L’énergie électrique lui est fournie par une pile à hydrogène (2) qui transforme ce gaz combiné à l’oxygène de l’air en eau et électricité.
Faisons un peu de chimie (3). Dans la pile à hydrogène à l’anode se produit la demi-réaction H2 → 2 H+ + 2e-. Les électrons passent alors dans le circuit extérieur de charge. Les ions H+ qui ont traversé la membrane (électrolyte solide laissant passer les ions mais bloquant les électrons) rencontrent à la cathode l’oxygène de l’air et la demi-réaction suivante se produit ½ O2 + 2 H+ + 2e- → H2O. Ces réactions sont catalysées par une micro-couche de platine. L’électricité fournie est envoyée dans des batteries ion/lithium (4) qui servent de tampon et alimentent les moteurs électriques de traction du train. Ces moteurs peuvent aussi lors des freinages et ralentissements envoyer du courant pour recharger ces batteries. Un algorithme règle le fonctionnement des piles et des batteries en fonction de l’énergie demandée pour économiser l’hydrogène. Le train peut emporter 300 passagers à des vitesses comprises entre 80 et 140 km/h avec une autonomie d’environ 800 km.
Sur la ligne en Allemagne, près de la gare de Bremervörde se trouve le « ravitaillement » alimenté par des camions-citernes d’Air Products. L’entreprise Linde fournira prochainement une station hydrogène sous la forme d’un grand container d’acier contenant l’hydrogène sous pression. Les trains s’arrêtent le matin pour faire en une dizaine de minutes le plein d’hydrogène qui est stocké dans des réservoirs sur le toit des voitures à côté des piles à hydrogène (5). Ce plein d’environ 200 kg d’hydrogène lui donne une autonomie d’environ 800 km ce qui est suffisant pour faire plusieurs allers et retours et desservir 5 gares par jour sur le trajet. Le Land de Basse-Saxe a déjà commandé 14 Coradia à Alstom qui devraient être livrés dès 2020. Pour les dirigeants allemands c’est une alternative écologique aux diesels car bien moins polluants. Certes pour l’instant ils fonctionnent avec de « l’hydrogène gris » issu du steam craking du gaz ou des hydrocarbures qui dégage du CO2 (6), mais l’objectif est d’avoir dans l’avenir de « l’hydrogène vert » (7) issu de l’électrolyse de l’eau par un courant électrique fourni par des éoliennes par exemple. Un champ de 10 MW pourrait d’après les calculs fournir par jour 2,5 tonnes d’hydrogène pouvant alimenter 12 à 14 trains.
Il est paradoxal que c’est en Allemagne que s’inscrit cette première mondiale alors qu’Alstom est une société française. Nous avons aussi en France le 2e fournisseur d’hydrogène mondial, Air Liquide, et nombre de start-ups performantes dans le domaine du stockage comme McPhy Energy. Toutes les conditions de recherche et de développement sont réunies, encouragées par le plan national de développement de l’hydrogène. Pour rattraper notre retard j’espère que le rapport de Benoit Simian permettra de voir que, plutôt d’électrifier les quelques centaines de voies secondaires, il sera plus économique de développer les Coradia d’Alstom sur le réseau français dès 2022, et que la réglementation sur l’hydrogène carburant évoluera comme en Allemagne. C’est pour le bénéfice de l’emploi, pour garder aussi une longueur d’avance en France pour le ferroviaire et pour lutter contre la concurrence chinoise de CRRC.
Jean-Claude Bernier et Catherine Vialle
Mars 2019
Pour en savoir plus :
(1) Chimie et transport, quel rapport ?
(2) Fonctionnement de la pile à combustible
(3) La chimie et le rail
(4) Piles à combustible et batteries au lithium
(5) Le transport ou le stockage de l’énergie électrique
(6) Et revoilà l’hydrogène
(7) L’hydrogène vert au secours des renouvelables
Vous connaissez sans doute « l’affaire du siècle » dont l’objet est d’attaquer l’État français au motif « d’inaction climatique ». C’est une initiative de quatre ONG, qui a recueilli sous forme de pétitions via les réseaux sociaux près de 2 millions de signatures. On peut bien sûr s’étonner qu’on ne se soit pas attaqué d’abord à l’État allemand ou chinois où la production de 1 kWh dans ces pays s’accompagne respectivement de l’émission de 550 g et de 700 g de CO2 alors qu’en France elle n’est que de 60 g (1). Mais d’après l’avocate de ces ONG, cette conduite française vertueuse n’est pas suffisante !
Or si jugement il y a, j’imagine que la justice voudra interroger toutes les parties et les choses risquent de se gâter. Car deux positions s’affronteront et la polémique qui enfle actuellement aux États-Unis et en Europe jusqu'en France sur le rôle du gaz carbonique comme élément essentiel de l’effet de serre et du réchauffement climatique s’y invitera (2). Des publications apparemment sérieuses de spectroscopistes spécialisés dans le rayonnement l’infra-rouge (IR) prétendent montrer que l’émissivité et l’absorption IR sont saturées dès 200 à 300 ppm de CO2 dans l’atmosphère et que le doublement de sa concentration ne modifierait en rien cette saturation. S’ensuit dans la littérature scientifique un débat sur les émissions infra-rouge de la Terre sous forme de courbes de Planck et leur modification dans la gamme d’absorption du CO2 autour de 15 microns. Il en est déduit que les climatologues « réchauffistes » ont eu tort dans leur modèle d’assimiler les molécules de gaz à des corps noirs dont les propriétés sont l’apanage des solides et non des gaz. Et donc que le CO2 ne peut contribuer à l’augmentation de température (3).
Cette thèse de plus en plus partagée est évidemment combattue par les scientifiques du GIEC qui maintenant expliquent que l’atmosphère est constituée de plusieurs couches en fonction de l’altitude, absorbant et réfléchissant l’IR, pour sauver leur modèle (4), et pour certains d’entre eux (pas tous) crucifiant les scientifiques s’opposant à leur thèse. Le problème est que les mesures disponibles des températures de la troposphère par satellites et ballons-sondes montrent qu’elles ne varient que très peu depuis près de 20 ans alors que les émissions de CO2 ont augmenté de plus de 10% (365 ppm en 1998, 408 ppm en 2018). De plus, les résultats des mesures s’écartent de plus en plus des modèles d’extrapolation des températures terrestres du GIEC qui prévoyaient en moyenne 0,4°C sur cette période. Plus grave encore est la fameuse courbe en forme de crosse de Hockey qui a disparu du 5e rapport du GIEC et qui avait affolé le monde politique et médiatique. D’après plusieurs spécialistes statisticiens elle aurait été manipulée par son auteur. Au secours de ce dernier plusieurs climatologues auraient aussi gommé l’optimum climatique de l’époque romaine et du Moyen Âge, en contradiction avec les preuves apportées par les historiens du climat et archéologues dignes de foi (5).
Ces polémiques jettent un trouble quasi tragique sur le modèle alarmiste de « l’urgence climatique » exigeant de la part de l’État des actions immédiates qui auront toutes chances d’avoir peu ou pas d’effet sur un phénomène qui serait du domaine de la variabilité naturelle. Au cours du dernier millénaire, canicules et sécheresses et petits âges glaciaires se sont succédé sans que le CO2 puisse être mis en cause. Avec une population en majorité croyante on entamait alors des processions ou des neuvaines pour que cessent ces phénomènes, aujourd’hui comme la religiosité a disparu, à l’heure des réseaux sociaux on pétitionne ! « Consensus omnium » !
Et pourtant dans un sujet aussi complexe que le climat, d’une erreur d’interprétation peut résulter un bien, en chimie une réaction loupée, un produit parasite peuvent nous en apprendre plus (6) sur les mécanismes réactionnels. Alors oui pour une meilleure isolation des bâtiments, oui pour une réduction de la consommation des ressources carbonées naturelles, oui pour l’énergie décarbonée, oui pour un changement de paradigme pour les transports. Transférons les milliards consacrés aux élucubrations climatiques à la recherche sur les véhicules électriques, sur les nouveaux réacteurs nucléaires, sur le stockage de l’énergie (7), sur le recyclage des matières de haute technologie, sur les procédés propres… Oui pourquoi pas à l’initiative de J. Jouzel et de P. Larroutourou pour le pacte finance - climat et à la création d’une banque européenne pour financer les recherches sur la transition énergétique, mais de grâce ne parlons plus de climat mais appelons le « pacte finance - préservation des ressources naturelles ».
Jean-Claude Bernier
Février 2019
Pour en savoir plus :
(1) Le challenge de l’électricité verte (Chimie et… junior)
(2) Le changement climatique (Chimie et… junior)
(3) Le changement climatique : question encore ouverte ?
(4) Le changement climatique : perspectives et implications pour le XXIe siècle
(5) Fluctuations climatiques extrêmes et sociétés au cours du dernier millénaire
(6) La maison écologique
(7) Cette « chère » transition énergétique
Lycéens, étudiants, et même parents, un avenir ça se prépare. Et si vous en êtes convaincus, il y a des coïncidences à ne pas manquer. Alors que Parcours up vient de s’ouvrir fin janvier, les 15 et 16 février prochain se tient à la Cité des sciences et de l’industrie à Paris le « Village de la chimie des sciences de la nature et de la vie », très grand rassemblement d’entreprises et d’établissements essentiel pour obtenir un large panorama des emplois et métiers de la chimie.
Le village regroupe plus de 30 entreprises, PME, starts-up et grandes industries, ainsi que plus de 30 établissements de formation, universités, grandes écoles et institutions spécialisées.
Ainsi vous pourrez au Village :
- vous informer auprès des entreprises des métiers, des profils recherchés, des déroulements de carrières dans l’industrie. Des spécialistes ingénieurs et des chargés des ressources humaines répondront à vos questions.
- vous orienter grâce aux établissements et aux responsables de formation présents qui vous renseigneront sur les filières et parcours du CAP au BTS, IUT, prépas, licences Pro, masters, écoles d’ingénieurs, doctorats, sans oublier l’apprentissage.
- vous préparer à la recherche d’emploi grâce aux ateliers pour vous entraîner à une utilisation efficace d’internet et des réseaux sociaux.
- vous exercer à l’entretien d’embauche et pourquoi pas vous initier à la création d’entreprise.
De nombreuses conférences et tables rondes peuvent aussi vous donner un large aperçu des applications novatrices de la chimie pour résoudre les grands défis de l’énergie, de l’environnement et de la santé.
La France a besoin de techniciennes et de techniciens, d’ingénieures et d’ingénieurs, de chercheuses et de chercheurs. La chimie et la biochimie sont les secteurs industriels où la parité homme/femme est presque réalisée. Venez nombreux et nombreuses, les métiers de la chimie vous attendent à la Cité des sciences et de l’industrie les 15 et 16 février.
En complément la tenue d’un stand d’information, le vendredi et le samedi à 14h, Mediachimie anime une conférence sur le thème : La chimie, science de l’innovation, recrute !
Découvrez les formations et les métiers qui embauchent sur le site d’orientation mediachimie.org.
Jean-Claude Bernier et Catherine Vialle
Février 2019
Site du village : http://www.villagedelachimie.org
Planning des conférences : http://www.villagedelachimie.org/inscrivez-vous/planning-des-conferences-et-ateliers/
La Journée de la mole est une fête officieuse célébrée par les chimistes, dont la date utilise la valeur du nombre d’Avogadro qui définit le nombre de molécules d’un élément dans une mole. Il vaut approximativement 6,02 × 1023.
En Amérique du Nord, elle est célébrée le 23 octobre à 6:02 (6:02 10/23 en prenant la date au format américain). En France plusieurs initiatives ont été lancées en choisissant la date du 6/02 à 10h23.
À cette occasion, Mediachimie vous propose de voir une courte vidéo sur Avogadro. La valeur du nombre d’Avogadro dans cette vidéo est celle en vigueur jusqu’au 19 mai 2019.
Amedeo Avogadro n'a pas eu la reconnaissance qu'il méritait à son époque. Docteur en droit de l'université de Turin, on le retrouve en 1800 à Paris où il travaille à la commission des poids et mesures. Désormais il aime la physique et la mathématique qu'il enseigne au Collège royal. Mais la chimie le rattrape et ce n'est qu'en 1811 qu'il formule sa fameuse hypothèse, contribution qui passera quasi inaperçue.
Homme doux et discret Amedeo vécut jusque 80 ans balloté par les diverses révolutions et changements de régimes italiens, consacrant son temps à son enseignement et sa famille. Il n'a pas recherché la célébrité.
Le "legislatore delle molecole" piémontais modeste devra la reconnaissance à un autre italien Stanislao Cannizzaro qui publie en 1858 son mémoire Sunto di un corso di Filosofia chimica (Résumé d'un cours de philosophie chimique) qui lève la confusion molécules - atomes et permet l'application de l'hypothèse d'Avogadro.
En savoir plus sur la définition de la mole
Depuis la 14e Conférence Générale des Poids et Mesures (CGPM) en 1971, la mole est une unité de base du système international SI définie de la façon suivante : « La mole (mol) est la quantité de matière d’un système contenant autant d’entités élémentaires qu’il y a d’atomes dans 0,012 kilogramme de carbone 12. » Sa valeur est mesurée à 6,022 140 857 × 1023 mol−1.
En novembre 2018 lors de la 26e CGPM, la mole a été redéfinie à partir de la valeur numérique fixée de la constante d’Avogadro. Le nombre d’Avogadro est fixée exactement à 6,022 140 76 × 1023 mol-1. Cette nouvelle définition entrera en vigueur le 20 mai 2019.
Voir aussi
https://www.lne.fr/fr/comprendre/systeme-international-unites/mole
Vous qui n’aviez pas la possibilité de venir à la Fondation de la Maison de la Chimie, vous avez pu assister en direct au « Colloque Chimie et Alexandrie dans l'Antiquité ».
sur Mediachimie ou sur Youtube
La captation des conférences sera bientôt disponible en ligne et le leur mise à disposition sera indiquée sur la page d'accueil de Mediachimie.
Alexandrie fut le plus grand foyer culturel de la Méditerranée, la plus grande ville du monde grec et un pôle commercial majeur.
Jean-Yves Empereur et Marie-Dominique Nenna, du Centre d’Études Alexandrines, se sont consacrés à l’étude du patrimoine archéologique et historique de la ville d’Alexandrie et ce, sous toutes ses formes, tant terrestres que sous-marines. Ces fouilles donnent accès à l’histoire de la ville d’Alexandrie depuis sa fondation en 331 avant J.-C. jusqu’à nos jours. L’ensemble des recherches ont permis de connaître et de comprendre le rôle d’Alexandrie dans les échanges en Méditerranée et au-delà avec la production et le commerce, notamment de céramiques, d’amphores, d’objets en verre, de la pierre architecturale comme des pierres semi précieuses. La chimie a joué un rôle important dans le monde alexandrin antique et elle joue aussi un rôle important dans l’étude archéologique et dans la conservation de ces témoignages.
Des experts de ces différents domaines vont illustrer ces points à partir de nombreux exemples issus du patrimoine alexandrin et vont montrer l’extraordinaire évolution récente de la recherche archéologique qui permet d’avoir accès à une compréhension renouvelée du patrimoine de l’humanité et de le rendre accessible au plus grand nombre.
Ce message s’adresse tout particulièrement aux étudiants de licence, master et doctorat, mais aussi BTS et IUT de chimie tout comme aux professeurs de ces filières. La finale internationale des Olympiades internationales de la chimie aura lieu à Paris à l'ENCPB (75013 Paris) en juillet 2019.
Les organisateurs sont à la recherche de bonnes volontés pour les aider dans cette aventure :
- soit en jouant vous-même un rôle pendant les Olympiades, que ce soit comme guide de délégation, responsable de salle de TP, assistant de laboratoire, ou secrétaire scientifique ;
- soit en diffusant cette affiche et en l'affichant dans tous les endroits où des chimistes, et plus particulièrement des étudiants, pourraient la voir.
L'attention est attirée sur le fait que les bénévoles doivent s'exprimer couramment en anglais voire, aussi, si possible, dans une autre langue.
Pour toute information : contact-icho2019@laligue.org, recrutement.icho2019@laligue.org et aurelien.moncomble@univ-lille.fr
Mi-janvier, la route du Tanneron (06) s’illumine d’une teinte jaune dorée avec l’éclosion des mimosas. Tout en bas au carrefour, des gilets jaunes facilitent la circulation loin des agitations parisiennes. Tout est jaune en ce pays grassois où nos sens s’enivrent d’effluves et de lumière (1).
Mais qu’est-ce vraiment que la couleur jaune ? En réalité c’est une sensation physiologique (2). Lorsqu’un photon de longueur d’onde 580 nm frappe les cellules cônes de notre rétine, le rétinal, qui est lié à une protéine - l’opsine, entame une photo-isomérisation qui déclenche une série de réactions biochimiques provoquant des impulsions électriques transmises au cerveau via le nerf optique. L’interprétation du cerveau de ces impulsions conduit à l’identification du jaune. On aurait la même sensation à la perception simultanée de deux lumières, l’une à 700 nm (rouge) et l’autre à 530 nm (vert), qui au cerveau reconstitueraient le jaune, la vision des couleurs par le système œil-rétine-cerveau fonctionnant avec une synthèse additive des couleurs.
La vision enchanteresse des pompons des fleurs de mimosa ne doit pas nous faire oublier que dans le sud, cette plante est devenue quasi invasive tant elle se plait dans le climat ensoleillé de la Côte d’Azur. Curieusement elle n’est pas indigène. Elle a été ramenée d’Australie vers l’Angleterre à la fin du XVIIIe siècle par les botanistes de l’expédition de James Cook et pour la France, ce fut l’expédition dans les terres australes de Nicolas Baudin au début du XIXe siècle qui ramena les premiers pieds vivants. Dès 1880, elle fleurit en pleine terre dans les jardins d’un château à Cannes La Bocca. Cette plante qui fleurit en hiver se souvient peut-être de sa date de floraison dans l’hémisphère Sud !
Tout autour de Grasse, les mimosas sont une matière première pour la fabrication des parfums. Des fleurs on extrait l’huile essentielle (1800 g pour 1000 kg) par hydrodistillation (3). L’extraction par solvants volatils comme l’hexane ou l’éther de pétrole puis filtration permet d’obtenir un concentré dit « concrète » (pâte plus ou moins solide). Ces « concrètes » sont alors solubilisés à chaud dans l’éthanol pour obtenir après filtration « l’absolue de mimosa » (4). Sont présentes alors quantité de molécules, entre autres : l’ester méthylique de l’acide salicylique, l’aldéhyde benzoïque, l’aldéhyde cuminique, le géraniol et des terpènes comme le triterpénol ou le lupénol. Cette « absolue » très chère est une base pour toute une série de parfums (Amarige, Paris, Champs Elysées, Moment Suprême…). Leurs caractéristiques : une odeur herbacée, de miel poudré, de vanille. L’huile essentielle diluée est recommandée comme antiseptique, anti-stress et apaisante.
Pour revenir au jaune des gilets, les gilets de sécurité dits de haute visibilité (sic) sont obligatoires pour les personnels sur les chantiers (5) et depuis 2008 en France dans les automobiles. Ils sont en tissu de coton ou en polyester respirant dont les fibres sont traitées avec des pigments fluorescents (6) c’est-à-dire qu’ils renvoient la lumière (7) lorsqu’ils dont éclairés par un flux d’excitation compris entre 360 et 405 nm, d’un jaune lumineux ! Les pigments organiques sont nombreux, bien sûr le plus ancien la fluorescéine, mais aussi la rhodamine, la coumarine, les cyanines… Les gilets montrent aussi des bandes grises réflectorisantes qui comportent des microbilles ou des micro-prismes de verre qui peuvent briller fortement même sous un faible éclairage et solliciter prioritairement nos cellules bâtonnets de la rétine.
Il vous reste si vous voulez rester branchés en ce mois de janvier à vous nourrir d’œufs car leur jaune est très riche en caroténoïdes comme la lutéine et la zéoxantine. Ils ont aussi un bon pouvoir liant et émulsifiant (8).
Surtout n’en faites pas une jaunisse tout cela passera en février à la chandeleur, avec les crêpes, rondes et jaunes comme le Soleil !
Jean-Claude Bernier et Catherine Vialle
Janvier 2019
Pour en savoir plus
(1) Lumière et couleurs (vidéo)
(2) La chimie crée sa couleur… sur la palette du peintre
(3) Hydrodistillation (vidéo)
(4) Ingrédients odorants et design olfactif
(5) Vers des textiles intelligents pour des vêtements performants et innovants
(6) Le textile, un matériau multifonctionnel
(7) L’art du verrier : des nanotechnologies depuis l’Antiquité !
(8) La chimie des sens ? Il y a tant de découvertes à faire !
La lettre d’information « Le Catalyseur » (PDF) du mois de janvier 2019 de France Chimie Île-de-France vient de paraître. Nous vous recommandons une lecture attentive de l’article de Bernard Bigot, Directeur Général de l’Organisation ITER, Président de la Fondation de la Maison de la Chimie, qui appelle à « briser le mur de l’ignorance » et à « donner l’écho d’une chimie multiple, productrice de richesses, de mieux-être et de sécurité ».
En ce temps de fêtes de Noël et de fin d’année, de nombreuses molécules vont nous bercer et nous enchanter, contribuant à l’atmosphère gourmande et odorante.
Tout d’abord place au roi de la fête : le chocolat (1) fabriqué à base d’ingrédients naturels dont le cacao et le sucre. Le cacao contient des polyphénols qui piègent les radicaux libres toxiques pour l’organisme. Il contient aussi des triglycérides dont en majorité l’acide oléique (2), un acide gras insaturé (omega-3), ingrédient idéal pour combattre le cholestérol (3). D’autres oligoéléments y sont présents comme le magnésium, le phosphore et le potassium sans oublier des endorphines stimulantes et euphorisantes (4), bien nécessaires en hiver.
Viennent aussi d’autres molécules au sein des délicieux pains d’épices. D’abord le gingérol du gingembre lui donne son piquant. Pour le gout de saveur douce, sucrée et un peu épicée, la molécule responsable est la zingérone qui apparait lorsque le gingembre est chauffé pendant la cuisson (5).
Pour se réchauffer en ville, vous prendrez bien un cornet de marrons bien chauds. Lorsqu’elles sont grillées, les châtaignes dégagent quantité de composés volatils par réactions à haute température. La chaleur développe aussi diverses molécules dont le γ-butyrolactone qui donne en bouche un léger gout sucré caramélisé et le furfural qui apporte le côté boisé avec une légère odeur d’amande (6).
Les molécules odoriférantes sont aussi de la partie pour Noël. Ne serait-ce que l’odeur forte et magique des aiguilles du sapin. La responsable est la molécule pinène, présente sous ses deux formes isomères α et β. L’α-pinène est connu comme antiseptique présent également dans la lavande et la sauge. L’autre odeur fraiche du sapin est celle de l’acétate de bornyle utilisé aussi dans les parfums ou les désodorisants (7). Synthétisé naturellement par plusieurs conifères il est aussi utilisé en phytothérapie pour ses propriétés sédatives (8). Côté cadeaux, vous recevrez ou offrirez peut-être des parfums, subtils mélanges de produits naturels et de composés synthétisées (9) (10).
Enfin, si lors des repas de fêtes vous garnissez la table avec du houx n’ingérez pas les baies rouges, elles contiennent des alcaloïdes qui peuvent être toxiques en grande quantité (11). De même, en vous embrassant sous le gui à la Saint-Sylvestre comme le veut la tradition, ne laissez pas trainer par terre trop de baies blanches translucides, elles contiennent de la viscotoxine qui est toxique, tant pour les hommes que pour les animaux de compagnie.
Laissez-vous entourer de molécules naturelles et euphorisantes. Joyeux Noël et bonnes fêtes !
Jean-Claude Bernier et Catherine Vialle
décembre 2018
Pour en savoir plus sur Mediachimie.org
(1) Le chocolat est-il bon pour la santé ?
(2) Acide oléique (produit du jour de la SCF)
(3) Les emplois thérapeutiques du chocolat
(4) Sport et cerveau (Chimie et... Junior)
(5) Le gout : de la molécule à la saveur
(6) Les méthodes de mesure des odeurs : instrumentales et sensorielles
(7) Vision d’avenir de l’industrie dans le domaine des parfums, arômes, senteurs et saveurs
(8) Un exemple de production de substances actives ; le pouvoir des plantes
(9) Le laboratoire des odeurs (vidéo)
(10) Ingrédients odorants et design olfactif
(11) La bonne chimie est-elle dans le bon dosage ?

Image d'illustration © DR. Images sous licence CC0 sauf cake pain épices (licence CC2, F. Voisin Demery)

Le cycle des Colloques “Chimie &…” s'enrichit d’un nouvel opus
Chimie et Alexandrie dans l'Antiquité
Mercredi 13 février 2019
Maison de la Chimie, 28 bis rue Saint-Dominique, 75007 Paris
À l’époque de l’apogée de la civilisation hellénistique, Alexandrie fut le plus grand foyer culturel de la Méditerranée, la plus grande ville du monde grec et un pôle commercial majeur. Depuis sa création en 1990 le Centre d’Études Alexandrines, sous les directions successives de Jean-Yves Empereur et Marie-Dominique Nenna, se consacre à l’étude du patrimoine archéologique et historique de la ville d’Alexandrie et ce, sous toutes ses formes, tant terrestres que sous-marines. Les fouilles terrestres concernent les contextes domestiques, utilitaires, religieux et funéraires. Les fouilles sous-marines portent principalement sur le site du phare d’Alexandrie et sur les épaves un peu plus au large.
Ces fouilles donnent accès à l’histoire de la ville d’Alexandrie depuis sa fondation en 331 avant J.-C. jusqu’à nos jours. Les objets tant du monde gréco-romain que du monde arabo-musulman montrent un monde où les réseaux eurasiens d’échanges se sont rencontrés pour partie à Alexandrie dans un processus accéléré de globalisation.
L’ensemble des recherches menées par le Centre d’Études Alexandrines permet de connaître et de comprendre le rôle d’Alexandrie dans les échanges en Méditerranée et au-delà avec la production et le commerce, notamment de céramiques, d’amphores, d’objets en verre, de la pierre architecturale comme des pierres semi précieuses. La chimie a joué un rôle important dans le monde alexandrin antique et elle joue aussi un rôle important dans l’étude archéologique et dans la conservation de ces témoignages.
L’archéologie moderne utilise en effet largement les méthodes de la chimie, non seulement pour la caractérisation, mais aussi pour la conservation et la restauration des objets. Elle permet aussi de redécouvrir la chimie utilisée dans des technologies de fabrication des objets du monde antique et médiéval, celle des matériaux utilisés, mais aussi de comprendre la chimie du vieillissement des objets des fouilles sous-marines.
Des experts de ces différents domaines illustreront ces points à partir de nombreux exemples issus du patrimoine alexandrin et montreront l’extraordinaire évolution récente de la recherche archéologique qui permet d’avoir accès à une compréhension renouvelée du patrimoine de l’humanité et de le rendre accessible au plus grand nombre.
Bernard BIGOT
Président de la Fondation de la Maison de la Chimie
Directeur Général de l’Organisation internationale ITER
Les inscriptions, gratuites mais obligatoires, sont ouvertes dès à présent.
Mediachimie a été présent au Salon européen de l'éducation et a organisé le vendredi 23 novembre 2018 une conférence animée par Françoise Brénon-Audat et Freddy Minc sur :
La chimie, science de l'innovation, recrute
Découvrez les formations et les métiers qui embauchent à l'aide du site mediachimie.org
Plus de 100 jeunes, des professeurs, des responsables d’orientation et des parents ont participé à cette conférence. Un échange s’est instauré à l’issue de cette présentation et chacun a pu repartir avec le maximum de renseignements tant sur la richesse de notre site que sur les filières de formation possibles.
Retrouvez ces informations dans l'Espace Métiers de Mediachimie.org

Le 16 novembre dernier à Versailles la Conférence générale des poids et mesures (CGPM) a voté la condamnation du « grand K ». À partir du 20 mai 2019 la définition du kilogramme sera basée sur une constante fondamentale de la physique : la constante de Planck h en kg.m2/s ; le « grand K » n’a donc plus que six mois à vivre.
C’est toute l’histoire du système international d’unités (SI) qui bascule. La création du système métrique décimal remonte à la Révolution française. Les définitions du kilogramme, basé sur le poids d’un décimètre cube d’eau pure à 4°C, et du mètre, correspondant au dix millionième de la distance du pôle Nord à l’équateur sur le méridien de Paris, n’étaient plus satisfaisantes.
Dès 1799 deux étalons furent forgés en platine (1) : un cylindre d’un kilogramme et une barre d’un mètre de longueur. Afin d’accroître la stabilité des étalons, deux nouveaux étalons furent forgés en 1889 dans un alliage de platine iridium (2). Le cylindre de 39 mm de haut fut alors enfermé sous trois cloches de verre dans un coffre-fort au Bureau international des poids et mesures (BIPM) à Sèvres près de Paris : c’est « le grand K », qui a servi de référence pendant près de 130 ans. Plusieurs répliques ont été faites dès 1875 lorsque le système international d’unités (SI) fut adopté par plus de soixante pays. Le « grand K » n’a quitté sa chambre forte que trois fois pour le comparer à ses « enfants », on s’aperçut alors qu’au fil du temps la masse du « grand K » était inférieure de 50 microgrammes à celles de ses répliques (5.10-8 kg, un grain de sable).
Lors de la 21e Conférence générale des poids et mesures en 1999, il fut demandé aux laboratoires nationaux d’affiner les expériences pour relier l’unité de masse à des constantes fondamentales. En France les chercheurs du CNAM, du LNE (Laboratoire national de métrologie et d’essais) et de l’Observatoire de Paris unirent leurs efforts pour confronter leurs résultats avec ceux du NRC (National Research Council) au Canada et du NIST (National Institute of Standards and Technology) aux États-Unis, ce qui aboutit en 2017 à la détermination de la valeur de la constante de Planck h avec une incertitude de moins de 5.10-8. Les chercheurs ont utilisé pour cela une balance de Kibble, une balance un peu particulière car elle ne comporte qu’un seul plateau, l’autre étant constitué d’une boucle magnétique au centre de laquelle on fait passer un courant précis dans un conducteur qui développe une force électromagnétique que l’on relie à la constante de Planck. Une seconde méthode utilisée par des chercheurs allemands consiste à fabriquer une sphère parfaite en silicium cristallisé très pur (3) d’un kilogramme. En comptant le nombre d’atomes de cette sphère, on calcule le nombre d’Avogadro avec une grande précision que l’on relie aussi à la constante de Planck. Grâce à ces méthodes et à la confrontation des résultats en 2017 la valeur de la constante a été fixée à h = 6,626 070 15 × 10−34 kg.m2.s-1 (J.s en SI).
Dans la foulée et en cascade à partir de mai 2019, la seconde, le mètre, le kilogramme, le kelvin, l’ampère (4), le candela et la mole (5) auront des définitions actualisées. Donnons quelques exemples :
- la seconde, calée sur la fréquence de transition hyperfine du césium 133 égale à 9 192 631 770 Hz équivalent à s-1
- le mètre à partir de la vitesse de la lumière dans le vide c = 299 792 458 m.s-1
- le kilogramme à partir de sa relation avec h = 6,626 070 15 × 10-34 kg.m2.s-1
- la mole, unité de matière, qui contient 6,022 140 76 × 1023 entités élémentaires, correspondant à la valeur de la constante d’Avogadro NA en mol-1
Toutes ces valeurs sont issues des quatre constantes h (constante de Planck), e (charge élémentaire), k (constante de Boltzmann) et NA (nombre d'Avogadro) qui ont nécessité un travail long à l’échelle internationale depuis plusieurs dizaines d’années, avec de multiples expérimentations. Elles ont permis la convergence des résultats, entérinés par CODATA (Committee on Data of the International Council for Science).
On peut se poser la question de savoir si ces précisions sont vraiment utiles ? En fait, pour la seconde et la mesure du temps, on connait la précision des horloges atomiques qui ont permis la définition étonnante des GPS. Pour la médecine et la pharmacie la définition exacte des doses et micro-formulations a besoin de références. Pour nos balances de ménage et nos pèse-personnes ce n’est pas 50 microgrammes après la retraite du grand K qui changera nos vies. En revanche, c’est une nouvelle ère qui s’ouvre pour la métrologie où l’on change de paradigme. En effet, les constantes ne reposent plus sur des objets matériels mais sur des facteurs physiques de nature fondamentale universelle.
Jean-Claude Bernier et Catherine Vialle
novembre 2018
Pour en savoir plus
(1) Produit du jour de la Société chimique de France
(2) Le mètre de 1889
(3) Toujours plus petit ! (Chimie et… junior)
(4) Ampère et la chimie
(5) La constante d’Avogadro (vidéo)
Voir aussi sur le site du LNE (Laboratoire national de métrologie et d’essais)
Le kilogramme
Introduction au système international d’unités

Réplique du Grand K. © National Institute of Standards and Technology.
Mediachimie est présent au Salon européen de l'éducation et organise une conférence animée par Françoise Brénon-Audat et Freddy Minc sur :
La chimie, science de l'innovation, recrute !
Découvrez les formations et les métiers qui embauchent à l'aide du site mediachimie.org.
Salon de l'Orientation - Vendredi 23 novembre 2018, 11h30, Salle 2
L’IUPAC fêtera son centenaire en juillet 2019 à Paris.
L’approche de ce centenaire fournit l’occasion d’y consacrer un temps d’étude. C’est ainsi que des spécialistes se réuniront à Paris pour débattre de ce sujet.
Le vendredi 16 novembre (au GHC, 250 rue Saint-Jacques, 75005 Paris), un symposium ouvert à tous permettra de présenter au public les premières études sur l’IUPAC, le contexte international et scientifique dans lequel elle se place ainsi que d’ouvrir le débat aux chimistes qui célèbrent le centenaire de leur Union.
Le programme est disponible : http://www.societechimiquedefrance.fr/spip.php?page=news-entite&id_rubrique=147
Ce colloque international est organisé par le Groupe d’histoire de la chimie GHC-SCF, avec le patronage du CNRS, du CNC, du congrès IUPAC2019, du GHDSO, et du Science History Institute de Philadelphia.
Inscription obligatoire auprès de : danielle.fauque@u-psud.fr
En 1914, l’industrie chimique organique en France est quasi inexistante, elle ne représente que 2 % du marché mondial alors que celle de l’Allemagne approche les 85 %. La chimie minérale et l’électrochimie avec la production de soude, de chlorates et de phosphates (1) est un peu plus vaillante avec des sociétés comme Saint-Gobain, Air Liquide ou Kuhlmann. Malgré les avertissements des chimistes alsaciens qui avaient fui leur province pour Paris après 1870, inquiets de voir l’hégémonie industrielle allemande s’appesantir sur la France sans sursaut de la part du gouvernement et des investisseurs. Albin Haller (2), qui avait réformé l’enseignement à Paris et à Nancy des ingénieurs chimistes, déplorait le manque de liaison entre l’université et l’industrie tout comme Lebon qui disait : « Les laboratoires étaient des sanctuaires de science pure, où ne parvenait pas le bruit de l’usine, et l’usine vivait d’empirisme et de routine » (3). Un autre chimiste, Charles Moureu, affirmait : « Il est certain que sans la puissance de son industrie, et tout particulièrement de son industrie chimique (…), jamais l’Allemagne ne nous eût déclaré la guerre ».
Cette faiblesse française apparait dès 1914 lors de l’erreur stratégique du haut commandement militaire qui escomptait une guerre courte et un approvisionnement de 10 000 obus par jour. Or, dès octobre 1914, c’est 100 000 obus par jour qui seront nécessaire. Le manque d’explosifs et la prise des mines de charbon et de fer du Nord et de l’Est privent de plus l’approvisionnement en benzol et en coke. Le gouvernement réagit et dès 1914 crée l’Office des produits chimiques et pharmaceutiques et nomme en 1915 un comité de direction de chimistes dont Albin Haller sous la présidence d’Auguste Béhal. Très vite, sous l’impulsion des ministères du Commerce et de l’Armement nait la Commission des matières colorantes qui initie le Syndicat national des matières colorantes (SNMC) qui deviendra très vite la Compagnie nationale des matières colorantes (CNMC). Celle-ci, avec le Service des poudres, contribue à la fabrication de tous les produits explosifs, composés chimiques et colorants. Fin 1915, un ambitieux programme soutenu financièrement par l’État se met en place, la chimie devient un but essentiel de l’économie de guerre.
La guerre chimique déclenchée par les Allemands par les attaques au chlore en 1915 (4) illustre la réaction française. En France la production de chlore était quasi nulle. Seules trois usines étaient capables d’en produire dont celle de la Motte-Breuil dans l’Oise sous séquestre car appartenant à Hoechst. Un contrat américain avec Dupont de Nemours apporte quelques tonnes. Mais l’État permet au groupe industriel de Alexandre Giros et de Louis Loucheur de construire à Pont-de-Claix près de Grenoble une usine qui dès mars 1916 produira des tonnes de Cl2. Dans la foulée près de dix usines électrochimiques sont équipées et financées. Deux usines construites en Tunisie approvisionneront en brome. Après 1917, une même réaction et collaboration en recherche et industrielle permettra de produire un autre gaz toxique, l’ypérite, qui avait été employé par les forces allemandes.
Pour les explosifs, le benzol, l’acide sulfurique et surtout l’acide nitrique et les nitrates manquaient. Il fallait s’approvisionner avec difficulté en nitrates du Chili, alors qu’en Allemagne, grâce au procédé Haber-Bosch, ammoniac (5) et nitrates étaient produits à partir de l’azote et des milliers de tonnes d’engrais peu coûteux s’amoncelaient pouvant aussi bien servir comme explosifs. C’est pourquoi après l’armistice de 1918 les diverses usines de l’IG Farben dont l’immense site d’Oppau furent occupés et les services chimiques français réclamèrent la divulgation de l’ensemble des procédés utilisés pour les armes de guerre. Les sociétés allemandes s’y refusèrent et réclament l’arbitrage de la Commission d’armistice. Celle-ci sous l’influence des Anglais et des Américains déclara que la « synthèse des nitrates revêt[ait] un caractère commercial et non militaire ». Nos chimistes de la délégation ne s’avouèrent pas vaincus et lors des pourparlers en 1919 et dans la rédaction du Traité de paix il y eut bien sûr une référence à l’industrie chimique allemande coupable de l’initialisation de la guerre chimique et l’exigence de l’anéantissement des usines de l’IG Farben où les gaz toxiques et les nitrates avaient été produits de 1914 à 1918.
C’est alors que se place en juin 1919 une rocambolesque négociation. Carl Bosch, qui était le chimiste de la délégation allemande, fut aperçu nuitamment franchissant les murs d’enceinte du parc où résidait la délégation pour rencontrer en secret un conseiller du ministère de l’Armement et des fabrications de guerre qui faisait partie de la Commission de contrôle des usines chimiques outre-Rhin. C’était le frère du futur directeur de la CNMC qui regroupait toutes les industries chimiques françaises soutenues par l’État. Bosch qui savait (et pour cause) que les brevets avaient été conçus pour les rendre inintelligibles aux étrangers de la chimie organique allemande et que la destruction des usines de l’IG Farben ne serait d’aucun secours à l’industrie chimique française négocia un accord avec les chimistes qui remonta au plus haut niveau. Cet accord stipulait la sauvegarde des usines chimiques outre-Rhin contre la révélation du procédé Haber-Bosch et l’aide des chimistes allemands pour la construction sur le territoire hexagonal d’usines de synthèse de NH3 et de nitrates. Dès 1920 le gouvernement français suscita un groupe d’industriels intéressés par la mise en application des brevets et des procédés. L’Office national industriel de l’azote (ONIA) fut créé en 1924 et plusieurs usines s’installèrent sur le site de l’ancienne poudrerie de Toulouse. Dès 1927 l’ONIA devint le premier producteur et exportateur de nitrate d’ammonium, maintenant connu sous le nom AZF (6).
L’économie de guerre avec un dirigisme étatique fort va changer l’industrie. Les entreprises chimiques comme celles des autres secteurs manquaient d’innovation et de capital pour l’investissement, les commandes de l’État entre 1914 et 1918 vont modifier largement le panorama. L’industrie chimique trop éparpillée va évoluer à marche forcée. La SCUR (Société chimique des usines du Rhône) bénéficiant de marchés captifs sur le phénol et les explosifs (7) multiplie son chiffre d’affaire par quinze, les bénéfices de la société Saint-Gobain augmentent de 70 %, la CNMC absorbe plusieurs compagnies et profite du rebond de la chimie organique. Michelin qui fournit les pneus des camions va accumuler un capital qui lui permettra, dès 1919 et l’essor de l’automobile, d’investir et de devenir une des toutes premières industries.
Après 1918, plusieurs écoles d’ingénieurs chimistes se créent sur le modèle de l’ESPCI, de Nancy de Mulhouse, la recherche universitaire dialogue avec l’industrie d’autant que Saint-Gobain, Air liquide, la SCUR, Michelin… ont la taille et les besoins en compétences pour jouer un rôle international. Cette évolution industrielle se double d’une évolution sociétale où, après la saignée de plusieurs millions d’hommes, les femmes prennent une place essentielle dans l’économie. La jeune industrie automobile et la naissante industrie aéronautique comme l’industrie chimique vont croître, sans faire oublier l’hécatombe et le sacrifice de millions d’hommes jeunes et de civils.
Jean-Claude Bernier
Novembre 2018
Pour en savoir plus
(1) Données industrielles, économique, géographiques sur les principaux produits chimiques, métaux et matériaux; L'élémentarium
(2) Solvay et la France. Un partenariat pour la chimie : Ernest Solvay – Albin Haller
(3) La chimie française dans la seconde moitié du XIXe siècle
(4) Il y a cent ans : la guerre chimique
(5) The Synthesis of Ammonia from Its Elements
(6) Enquête technique après accidents industriels
(7) L’industrie chimique française pendant la guerre : matières premières servant à la préparation des poudres et explosifs
Mediachimie est une médiathèque qui a pour vocation de présenter la chimie dans tous ses états, de ses balbutiements aux temps anciens jusqu’à ses avancées les plus récentes. Ses nombreuses ressources documentaires mettent en lumière la réelle et indispensable interpénétration de toutes les disciplines scientifiques. Chimistes, biochimistes, biologistes, géologues, physiciens, médecins, informaticiens… s’enrichissent mutuellement des avancées de chacun. C’est la combinaison de la contribution bien orchestrée de chaque discipline qui conduit à l’innovation et c’est ainsi que l’on peut s’émerveiller aujourd’hui des progrès spectaculaires dans les domaines par exemple des technologies de l’information, des nanosciences, des thérapies innovantes.
Ainsi, les enseignants de SVT pourront faire appel à des ressources accessibles depuis Mediachimie.org pour illustrer leurs enseignements comme par exemple :
Ressources pour les enseignants en Première S et Terminale S
- Fonctionnement du système nerveux : imagerie et optogénétique (captation d'une conférence et article associé)
Ressources scientifiques pour les enseignants ou pour les TPE en Première
- Odeurs et représentations mentales (captation d'une conférence et article associé)
- Le goût : de la molécule à la saveur (captation d'une conférence et article associé)
- Les ressources minérales du future sont-elles au fond des mers ?(article)
Seconde
Cycle 4
L’Union nationale des professeurs de physique et de chimie organise à Bordeaux son 66e congrès sur le thème " Ponts vers le futur ", illustrant la science qui se construit au jour le jour, en s'appuyant sur les connaissances passées et en étant tournée vers le monde de demain.
66e Congrès national de l'UdPPC
28-31 oct. 2018 Bordeaux - Talence (France)
Pour plus de renseignements : https://udppc-bx2018.sciencesconf.org/
Le dernier rapport alarmiste du GIEC coïncide presque avec le Salon mondial de l’automobile à Paris en cette mi-octobre. Bonne occasion pour voir si les nouveaux véhicules vont aider à rester sous 1,5 °C de réchauffement d’ici 2030 (1) ! Alors que la progression des ventes d’automobiles de l’ordre de 2,6 % annuels n’a pas été ralentie depuis l’accord de Paris de 2015, constructeurs et gouvernements dans un grand élan « médiaticologique » ont banni les véhicules thermiques (2) de leur vente, routes et villes d’ici 2030 ! D’où la floraison porte de Versailles et place de la Concorde de véhicules hybrides, hybrides plug-in, électriques, à hydrogène… Au-delà des annonces « green business » reprises par tous les media politiquement corrects, quelques voix de techniciens s’élèvent mettant en doute leur vocation de sauveurs de la planète à l’encontre de l’opinion moutonnière. Qu’en est-il ?
Faisons d’abord un sort aux hybrides avec ou sans plug-in qui rechargent leurs batteries avec le moteur thermique ou une prise dans le garage, ils n’ont d’électrique que le nom sur le catalogue. En général de gros SUV alourdis par une batterie et un moteur électrique annexe fleurissent aux abords des écoles où les parents hauts perchés montrent leur sentiment écologique aux têtes blondes. Quelques élus de la nation veulent qu’ils accèdent à une prime de 2000 € alors qu’ils ont une autonomie de 1000 km grâce à leur réservoir de gasoil en émettant à tout va du CO2 (3) et ne peuvent parcourir que 40 km au moteur électrique. Ce sont à l’évidence à 90 % des véhicules thermiques, ils n’ont rien d’électrique !
Les véhicules tout électrique vus au salon sont-ils différents ? Ils sont très beaux et tentants avec des autonomies comprises maintenant entre 250 et 450 km grâce à des packs de batteries ion–lithium (4) de réserve comprise entre 30 kWh et 60 kWh. Hélas de petits calculs simples font douter qu’ils répondent aux souhaits du GIEC d’utiliser des moyens de transport à énergie renouvelable (5) pour nous sauver du réchauffement climatique. Prenons l’exemple d’une automobile moyenne à la limite du malus en France. Elle émet 120 g de CO2 par kilomètre. Imaginons qu’elle parcourt 15 000 km/an au cours de son utilisation durant 10 ans, l’émission sera de
Prenons son équivalent électrique d’autonomie d’environ 300 km elle dépense 20 kWh/100 km. En la gardant 10 ans (en espérant garder la même batterie) et avec le même kilométrage de 150 000 km elle aura dépensé 30 000 kWh. Si ce parcours est fait en France, avec un mix électrique (6) qui donne 50 g CO2/kWh, l’émission équivalente sera de
Attention nous disent les spécialistes des cycles de vie, il faut aussi tenir compte de l’énergie nécessaire à la fabrication. On supposera que l’énergie nécessaire à l’élaboration carrosserie, moteurs, accessoires, est la même pour les deux véhicules. Par contre pour l’électrique s’ajoute celle nécessaire pour fabriquer le lourd pack de batteries : les spécialistes la montent à environ 15 000 kWh. Malheureusement pour nous, sur tous les véhicules électriques ces batteries viennent à 90 % d’Asie avec un mix électrique chinois qui donne l’équivalent de 11 500 kg de CO2 qu’il faut ajouter au bilan total. On voit alors qu’en Allemagne et en Chine la voiture électrique aura « émis » in fine respectivement 60 % et 100 % de CO2 de plus que la voiture thermique. On notera en passant l’avantage d’implanter une « gigafactory » en France parce qu’alors le supplément ne serait que de 750 kg de CO2.
Sont aussi exposés au Salon trois véhicules mus électriquement grâce à une pile à combustible utilisant l’hydrogène, disponibles en 2018, et figurent aussi de nombreux projets prévus au-delà de 2020 (7). Ce n’est pas la peine de rappeler aux chimistes qu’à 95 % l’hydrogène est obtenu par « steam cracking » du méthane ou hydrocarbures et que la production d’un kilogramme de H2 s’accompagne de la production de 10 à 20 kg de CO2. Pour ces magnifiques automobiles exposées il faut 1 kg d’hydrogène stocké à 700 bars pour parcourir 100 km ayant dégagé déjà 10 kg de CO2. Le même calcul sur le parcours durant 10 ans de 150 000 km conduit à une consommation de 1500 kg de H2 et une émission « décalée » de 15 000 kg de CO2. On pourrait y ajouter le supplément de fabrication de la pile (8) et de la batterie tampon, mais on peut se contenter de voir qu’il faut consacrer le tiers de l’énergie disponible de l’hydrogène pour le comprimer à 700 bars, soit 15 000 kWh. S’il est comprimé en France on ajoutera 750 kg de CO2, si c’est en Allemagne on ajoutera 8250 kg soit au total respectivement 15 750 kg et 23 250 kg de CO2 comparés au véhicule thermique (18 000 kg) et tant pis pour la Chine.
Vous voyez donc que constructeurs et élus dans un grand élan de « green washing » oublient de nous dire qu’il y a de forte variations de rejets de gaz de serre suivant les pays à mix électrique fortement décarboné comme la France ou la Norvège, moyennement comme l’Allemagne ou le Japon et peu ou pas comme la Chine ou l’Inde, avec des résultats qui montrent que dans les deux dernières situations les rejets sont pires pour les véhicules « propres » que pour le thermique. Les subventions à l’achat des hybrides et électriques ne seraient-ils pas mieux employés à investir en France pour une grande usine de fabrication de batteries, aujourd’hui importées à grand frais et à fortes émissions de CO2 depuis la Chine. Pour sauver la planète fabriquons et roulons en France, sinon marchons à pied ou faisons comme Gaston Lagaffe, installons sur notre voiturette électrique une éolienne sur le toit !
Jean-Claude Bernier
octobre 2018
Pour en savoir plus
(1) Le changement climatique : question encore ouverte ?
(2) Le moteur électrique comparé au moteur thermique, enjeux et contraintes
(3) Le gaz carbonique
(4) Applications présentes et futures de batteries
(5) Vers des transports décarbonés : carburants, combustion et post traitement pour les transports routiers
(6) Les enjeux de la chimie dans la production d’électricité
(7) L’hydrogène bientôt dans nos automobiles
(8) Fonctionnement de la pile à combustible
Dans le cadre de la Fête de la science, l’équipe de Mediachimie.org vous propose de rentrer dans le monde souvent surprenant et parfois magique de la chimie et de ses applications, au travers d’un quiz ludique et instructif.
C’est l’occasion de découvrir que la chimie est partout, qu’elle est présente en permanence dans notre quotidien et dans tout ce qui nous entoure. Source d'innovations et de progrès, elle accompagne les autres sciences et les autres technologies, dans tous les laboratoires de recherche, dans tous les domaines d'activités.
Avec ce quiz, testez vos connaissances et découvrez des innovations ou des applications inattendues, fruits de l'observation et de l'imagination des chercheurs, parfois aidés par ce que la Nature a su inventer avant nous.
Répondez avant le 4 novembre 18h.
Lots : Une tablette et 4 power banks.
À vos claviers !
L’année 2018-2019 a été désignée « année de la chimie, de l'école à l'université » par l’Éducation nationale et le ministère de l’Enseignement supérieur, de la Recherche et de l’Innovation. Pour accompagner cette année de la chimie, Mediachimie.org propose de nouvelles ressources qui seront ajoutées au fil de l'année
- des quiz en ligne pour apprendre en s'amusant
- des réactions et transformations chimiques qui ont changé l'histoire et la vie des hommes au cours des temps
- des fiches mettant en lumière les secteurs économiques où innovent et travaillent les chimistes
Accédez à la page dédiée à ces ressources
Un prix pour faire découvrir aux lycéens les innovations de la Chimie en faveur du développement durable
À l’occasion de l’année de la chimie de l’école à l’université qui se déroule sur l’année scolaire 2018/2019, le ministère de l’Éducation nationale, France Chimie, la Fondation de la Maison de la Chimie et la Société Chimique de France lancent la première édition du Prix Pierre Potier des Lycéens. Ce prix permettra à des lycéens de toute la France de découvrir des projets menés dans le secteur de la chimie en faveur du développement durable et de désigner parmi eux le projet qui leur semble le plus innovant.
Plus d’informations disponibles : http://www.anneedelachimie.fr/le-prix-pierre-potier-des-lyceens/
Inscriptions en ligne jusqu’au 19 octobre 2018 sur : http://www.anneedelachimie.fr/inscrivez-votre-classe/
Inspiré du « Goncourt des lycéens », ce prix est une déclinaison pour les lycéens du prix Pierre Potier qui met en lumière et récompense chaque année les initiatives des entreprises de la chimie en faveur du développement durable. Décerné par un jury composé de personnalités de la recherche, de l’industrie et de ministères, le Prix Pierre Potier est aujourd’hui un label de référence auprès des organismes de soutien des entreprises.
Tout au long de l’année scolaire 2018 / 2019, des élèves issus des classes de seconde, de première et de terminale des filières générales, technologiques et professionnelles découvriront ainsi les innovations des entreprises de la chimie en faveur du développement durable.
Dans un premier temps, les élèves devront étudier individuellement les présentations des projets et voter en ligne. Les projets retenus feront ensuite l’objet d’une séance spéciale de débats et d’échanges en classe avec leurs professeurs, en présence de représentants d’une entreprise de la chimie ainsi que de chercheurs membres du Réseau Jeunes de la Société Chimique de France. Ces moments de discussion seront une occasion de faire découvrir aux jeunes la démarche scientifique, de partager avec eux la culture de l’innovation et de les sensibiliser au monde de l’entreprise, aux métiers scientifiques et à l’entrepreneuriat. Enfin, à l’issue de cette phase d’étude et d’échanges, les élèves désigneront le projet lauréat.
Le Prix Pierre Potier des Lycéens sera remis à la fin de l’année scolaire à l’occasion de la cérémonie de la 12e édition du Prix Pierre Potier organisé à Paris par la Fondation internationale de la Maison de la Chimie et par l’UIC, sous le haut patronage du ministère de l’Economie et des Finances.
Plus d’informations disponibles : http://www.anneedelachimie.fr/le-prix-pierre-potier-des-lyceens/
Inscriptions en ligne jusqu’au 19 octobre 2018 sur : http://www.anneedelachimie.fr/inscrivez-votre-classe/
Le Grand Prix : Les jeunes journalistes de la chimie a été remis au binôme Benjamin Robert et Jimmy Leyes, lauréats 2018, par Bernard Bigot, président de la Fondation Internationale de la Chimie.
Le Grand Prix les jeunes journalistes de la chimie est un concours étudiant télévisé destiné aux futurs journalistes et organisé par la Fondation de la Maison de la Chimie en partenariat avec les journaux Sciences et Avenir, Le Figaro et MCE TV (Ma Chaine Etudiante TV).
Pour l’édition 2018, Benjamin Robert et Jimmy Leyes deux étudiants de l’École Supérieure de Journalisme de Lille ont remporté le concours avec le sujet : « L’impression fait peau neuve».
Félicitations !
Vidéo et article des lauréats
L'impression fait peau neuve (PDF - 221 Ko)
Discours de remise de M. Bernard Bigot
Retrouvez également les productions des autres équipes finalistes :
- La chimie interstellaire : vers l'inconnu et au-delà (Marietou Bâ et Lucie de Perthuis, École de Journalisme et de communication de Marseille)
- Le propanolol, une pilule pour oublier ? (Céline Delbecque et Antoine Piel, École de Journalisme de Sciences Po)
- Salmonellose : comment la chimie permet-elle de l'éviter ? (Cassandre Jaliffier et Romane Milloch, Master de journalisme et médias numériques de Metz)
En octobre, la sonde PSP (Parker Solar Probe) va entamer sa première révolution autour de Vénus pour accélérer en profitant de l’assistance gravitationnelle et se lancer dans sa première ellipse autour du Soleil en novembre. Il convient alors de rappeler comment la chimie (1) est concernée par cette exploration historique.
« Toucher le soleil » (2) est un vieux rêve que l’humanité et les scientifiques caressent avec envie depuis Icare. Le Soleil est en effet un gigantesque laboratoire où la fusion nucléaire, la gravité géante, la physico-chimie des plasmas et les tempêtes magnétiques posent autant de problèmes physiques inexplorés qu'ils suscitent de soifs de savoirs.
La couronne solaire s’étend sur plusieurs millions de kilomètres et est composée d’hydrogène, d’hélium, de carbone et d’ions de métaux de transitions. C’est là que sont générés les vents solaires qui se déploient à travers tout notre système planétaire. La température y est d’un million de degrés Celsius, soit 300 fois la température de surface du Soleil (5500°C). C’est dans la perspective d’étudier cette couronne que la sonde PSP va s’en approcher progressivement, jusqu’à une distance de 6 millions de km en 2024 lors de sa dernière rotation. Même à cette distance qui équivaut à plusieurs fois le rayon du Soleil, la température peut avoisiner 1300°C et le rayonnement émis est 600 fois supérieur à celui que vous avez peut-être reçu sur la plage cet été (3).
La sonde PSP embarque de multiples instruments et capteurs auxquels des laboratoires et équipes de chercheurs français ont collaboré pour étudier la vitesse et la densité du vent solaire : la caméra pour visualiser des parties de la couronne, le détecteur magnétique pour étudier les champs électriques et magnétiques, le capteur pour mesurer l’énergie des particules, ions, électrons et protons issus des éruptions solaires... (4).
Par exemple, le laboratoire de physique et chimie de l’environnement et de l’espace (LCP2E) d’Orléans a réalisé et assemblé le magnétomètre à induction SCM (Search Coil Magnetometer) pour l’étude ses champs dans le plasma. Le Laboratoire de physique des plasmas (LPP) à l’École polytechnique a conçu un spectromètre assemblé aux États-Unis pour étudier les turbulences du vent solaire. L’Institut de recherche en astrophysique et planétologie de Toulouse (IRAP) est sollicité pour l’interprétation des images de la caméra.
Tous ces instruments, circuits et capteurs doivent pouvoir résister aux rayonnements et hautes températures. Les circuits électriques et une partie de l’électronique (5) sont réalisés à base de niobium et de tungstène, métaux réfractaires à hautes températures de fusion. Il faut même un bouclier protecteur de ces instruments, de 2,4 mètres de diamètre, épais de plus de 11 cm et composé de deux panneaux en fibres de carbone (6) séparés par un sandwich de mousse de carbone et, sur la face qui sera exposée au Soleil, une couche céramique blanche réfractaire et réfléchissante.
Ces équipements ont été testés au laboratoire du CNRS PROMES qui dispose à Odeillo d’enceintes sous vide pour tester des objets de grande dimension à plus de 2000°C grâce au four solaire.
Les résultats des mesures devraient pouvoir permettre de connaître les processus de la surchauffe fantastique de la couronne sous l’influence d’ondes électromagnétiques et comprendre l’origine des tempêtes de vents solaires dont les vitesses de 200 à 800 km/s ont érodés la Lune et la planète Mars (7), faisant disparaître toute trace de vie et provoquant sur notre terre des perturbations électriques et magnétiques qui peuvent avoir des répercussions dramatiques dans les télécommunications et le climat (8).
Jean-Claude Bernier
Septembre 2018
Pour en savoir plus :
(1) La chimie et l’espace
(2) Spectre et composition chimique du soleil (vidéo)
(3) De la terre au soleil (vidéo)
(4) Fusion au cœur des étoiles (vidéo)
(5) De la chimie au radar du Rafale
(6) Les nouveaux matériaux composites pour l’aéronautique
(7) De la chimie sur Mars
(8) Le changement climatique : question encore ouverte ?
La Délégation générale à la langue française et aux langues de France vient de publier une édition revue et augmentée du Vocabulaire de la chimie et des matériaux paru pour la première fois en 2007 : 582 termes et définitions concernant des notions nouvelles dont beaucoup n’avaient pas de désignation en français.
Voir sur le site de la Délégation générale à la langue française et aux langues de France
Télécharger : Vocabulaire de la chimie et des matériaux (2018) PDF - 1271 Ko
Venez participer aux Journées du Patrimoine à la Maison du Soleil à Saint-Véran les 15 et 16 septembre 2018 autour des thèmes Cadrans solaires de Saint Véran et au-delà et Cristaux, mines de cuivre et océan.

Samedi 15 Septembre
Cadrans solaires de Saint-Véran et au-delà
- 15h - 17h : Atelier cadrans solaires (6 - 15 ans)
- 17h30 : Visite autour des cadrans solaires de Saint-Véran (adultes et enfants)
- 18h30 : Conférence : L'art et l'histoire des cadrans solaires haut-alpins par Elsa Giraud (adultes et enfants)
Dimanche 16 Septembre
Cristaux, Mine de cuivre et Océan alpin
15h - 17h : Atelier fabrication de cristaux (6 - 15 ans)
17h - 19h : Conférence sur l'histoire géologique de l'océan alpin et de la mine de cuivre de Saint-Véran par Raymond Cirio (adultes et enfants)
Toutes les activités sont gratuites.
Contact :
Maison du soleil - Saint-Véran - Hautes-Alpes
04 92 23 58 21
www.saintveran-maisondusoleil.com
contact@saintveran-maisondusoleil.com
L’actualité de cet été 2018 a été marquée par les annonces et descriptions de feux de forêts. Le Portugal, la Grèce, la Suède, la Californie ont été les théâtres de gigantesques incendies très médiatisés où l’élévation de température (1) ou des actes criminels (2) ont eu leurs rôles. Des centaines de milliers d’hectares et habitations ont été détruites malgré les grands moyens de lutte mis en action. Quelles sont les réactions chimiques présentes lors de ces embrasements et de leurs extinctions ?
Lors d’un feu de forêt, hors de la combustion du carbone des végétaux qui dégagent des oxydes de carbone CO2 et CO (3), de nombreux composés organiques volatils (4) sont présents dans les fumées issues de la pyrolyse de la cellulose. Ces composés ont été très étudiés par le CEREN en fonction du type de végétaux :
- pour le chêne les fumées contiennent des composés benzéniques et phénoliques tels que C6H6, C7H8, du furfural C5H4O2, l’acide acétique, le p-crésol sont aussi présents, mais peu de terpènes ;
- pour les ajoncs, buissons épineux et broussailles de sous-bois les fumées sont riches en benzène (5), toluène, xylène et acide acétique, mais pas de terpènes ;
- pour le pin au contraire on trouve dans les fumées beaucoup de terpènes et peu de composés phénoliques.
Tous ces composés volatils qui se dégagent lors de la pyrolyse sont très inflammables et dès qu’ils rencontrent les conditions favorables de température et de concentration en oxygène ils transforment les arbres en torches incandescentes quasi explosives telles que nous les décrivent les pompiers sur place.
Hors les principes de préventions mis en place notamment en France et en Europe du Sud, comment lutter contre les incendies lorsqu’ils se sont déclarés ? Les principes sont toujours les mêmes :
- faire baisser la température de combustion (750 °C - 400 °C)
- priver les composés carbonés d’accès à l’oxygène de l’air
C’est pourquoi depuis toujours on arrose les flammes avec de l’eau (6). Sa chaleur latente de vaporisation très élevée permet à l’eau de puiser des calories au brasier et de faire baisser la température. Sa vapeur remplace l’oxygène de l’air.
Depuis les années 1960, on y ajoute des retardateurs de combustion non toxiques pour l’environnement. Ce fut d’abord des ajouts d’argile (7) en suspension comme la bentonite qui recouvre d’une couche les végétaux et retarde la pyrolyse. Puis des hydroxydes d’aluminium, [Al(OH)3], ou de magnésium, Mg(OH)2, qui à température élevée délivrent de l’eau et donnent les oxydes Al2O3 ou MgO réfractaires.
Actuellement les moyens aériens et additifs largués se sont perfectionnés. On distingue trois types d’ajouts :
- les retardateurs tels que les polyphosphates d’ammonium avec des argiles comme l’attapulgite dilués dans l’eau à 20 % ;
- les agents mouillants de types tensioactifs ;
- des agents moussants (8) comme l’hexylène glycol (ou 2-Methyl-2,4-pentanediol) et le n-octanol qui isolent de l’air le végétal par une couche de mousse adhérente.
Les techniques d’attaque du front de flamme se sont perfectionnées avec les célèbres canadairs qui en quelques secondes larguent 1/3 de leur charge de 7 m3 sur les flammes et 2/3 sur la végétation avant qu’elle soit atteinte par les flammes. On y ajoute un colorant qui est souvent l’oxyde de fer Fe2O3 de couleur rouge pour que les avions suivants voient bien la trace du largage précédent. Et que dire du supertanker de Boeing le 747–400 qui peut larguer en 10 secondes 72 m3 de mélanges que l’on a vu en action en Californie ? Mais finalement ne vaut-il pas mieux suivre en forêt les recommandations de prudence de la protection civile et des pompiers pour éviter la première flamme ?
Jean-Claude Bernier
Août 2018
Pour en savoir plus :
(1) Chimie atmosphérique et climat
(2) La chimie mène l’enquête
(3) Nom de code : CO2
(4) Pollution et feux de cheminées
(5) Sur la structure du benzène
(6) L’eau : ses propriétés, ses ressources, sa purification
(7) Biogéochimie et écologie des sols
(8) Les secrets des mousses, une interview de Claude Treiner