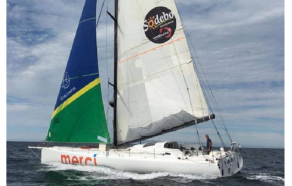
C’est le dimanche 8 novembre que sont partis des Sables d’Olonne les 33 voiliers du Vendée Globe 2020. Comme précédemment on s’attend à ce que le record de 2016 (1) soit battu compte tenu des innovations et nouveaux matériaux appliqués à ces voiliers IMOCA de 18 mètres préparés pour la course autour du monde depuis plusieurs années. Ce sont en effet des vitrines de technologie : mâts et coques en fibres de carbone, accastillages en titane, voiles en Kevlar ou fibres de carbone tissées, informatique et caméras embarquées du dernier cri. Mais cette année l’innovation la plus importante est sans doute la quasi-généralisation des « foils » (2).
Alors que dans la précédente édition 7 bateaux étaient pourvus de foils, cette année c’est plus de la moitié de la flottille, 19 navires sur 33, qui portent ces impressionnantes moustaches. De plus elles ont grandi. En 2016 les foils mesuraient 2 à 3 mètres, en 2020 ils font de 5 à 6 mètres. Conçus sur le même principe que les ailes d’avion, leur profil permet, lorsque plongés dans l’eau avec une certaine vitesse, de soulever la coque et donc de réduire les frottements et la prise au vent et ainsi gagner 20 à 30% en vitesse pure. Ces foils sont maintenant fabriqués par plusieurs entreprises du Morbihan. Ils sont en fibres de carbone entremêlées en 3D imprégnées de polyester (3). Un moule spécial en mousse reçoit les différentes couches de drapages sur plusieurs centimètres d’épaisseur. Après démoulage la cuisson permet de polymériser la résine (4) et donne la forme rigide du foil. Bien que légers les foils doivent cependant être très résistants car en plus des forces aérodynamiques ils supportent le poids du voilier qui se soulève et qui fait en tout 7 à 8 tonnes. Les cabinets d’études et les entreprises bretonnes ont dû repenser l’architecture des bateaux en fonction de ces foils et de leurs puits qui vont donner des allures inédites à ces « Imoca » de folie. Parallèlement c’est toute une industrie de R&D et de PME innovantes qui font de la Bretagne une vitrine des matériaux composites (5) de hautes performances qui est maintenant sollicitée pour des projets de navires de haute mer (6).
Il y a aussi cette année des originalités marquantes. Le skipper Sébastien Destremau sur son bateau « Merci » dans un souci écologique s’est équipé d’une « casquette » en carton. Dans le jargon nautique la « casquette » n’a rien d’un couvre-chef, c’est une pièce à l’arrière du bateau qui sert à protéger le barreur des embruns et du vent glacial. C’est la société DS Smith de Loire-Atlantique spécialisée dans les emballages recyclés qui a fourni 100 m2 de carton ondulé. Et c’est Stéphane Munoz « sculpteur cartonniste », créateur de meubles en papier rigide, qui a fabriqué la pièce de 3,6 m de longueur jusqu’à la veille du départ et qui a reçu un glaçage avec une résine époxy sans solvant. La casquette gardera-t-elle son imperméabilité lors du voyage ? Le skipper est engagé dans une démarche de réduction de son empreinte carbone (7) et il ne vise pas une place parmi les premiers de cette édition 2020.
Un autre bateau, l’Imoca « Newrest – Arts & Fenêtres » avec son skipper Fabrice Amedeo, mène aussi une démarche écologique. Il veut, avec trois laboratoires de l’IFREMER, de l’université de Bordeaux et de l’IRD, profiter de son périple dans des zones océaniques peu explorées pour recueillir et analyser les microplastiques. On sait qu’avec la dispersion des matières plastiques, on trouve dans les océans des milliards de billes de plastique de tailles comprises entre 300 et 50 microns qui suscitent des inquiétudes pour l’équilibre marin et des menaces pour la vie des poissons. Le bateau est équipé d’un capteur disposant de trois filtres de calibres différents. Le skipper devra changer les filtres toutes les 24 heures en notant sa position et recueillir les boites à filtres pour les analyses chimiques (8) ultérieures (polystyrène, polyéthylène, polyamide…) qui doivent permettre d’établir une cartographie de ces microplastiques dans les océans. Fabrice Amedeo ne vise pas le record de 74 jours : il emporte avec lui 85 jeux de filtres pour 85 jours en mer.
Cela rappelle l’aventure et le projet « Plastic Odyssey » lancés en 2018 par deux jeunes ingénieurs dont l’ambition est de faire marcher un navire avec les déchets plastiques trouvés sur les plages les plus polluées d’Afrique et d’Asie. Après une maquette de démonstration, ils ont acquis avec l’aide de nombreux sponsors et ONG un vieux navire océanographique le « Victor Hansen » qu’ils sont en train d’aménager avec un réacteur de pyrolyse à 400°C qui va dépolymériser ces déchets et les recycler sous forme d’une huile lourde récupérée par distillation, pouvant alimenter les moteurs de leur navire. Après avoir été bloqué plusieurs mois à Boulogne pour cause de désamiantage, le rétrofit est en cours. Ils pensent partir en 2021 pour un tour du monde avec multi-escales pédagogiques pour démontrer les possibilités du recyclage chimique des plastiques dont l’Europe et le monde auraient bien besoin.
Jean-Claude Bernier
Novembre 2020
Pour en savoir plus :
(1) Moins de 80 jours grâce à la chimie ?
(2) La chimie, une histoire de foils
(3) Les chimistes dans l’aventure des nouveaux matériaux
(4) Les polymères, ce qu’il faut savoir ! (vidéo)
(5) Les matériaux composites dans le sport
(6) Chimie et construction navale
(7) Papiers/cartons : les bons élèves du recyclage et du bilan carbone
(8) Techniques analytiques et chimie de l’environnement
Crédit photo : IMOCA Merci © Sébastien Destremau
Le prix Nobel de chimie 2020 vient d’être attribué à la française Emmanuelle Charpentier et à l’américaine Jennifer Doudna. Elles sont récompensées pour la découverte d’un outil génétique formidable, le CRISP-Cas9. On connait tous l’ADN molécule charpente de nos génomes (1) et caractéristique de toutes les cellules, dont les nôtres. Pour modifier ou éditer le génome il faut pouvoir modifier les séquences de cette molécule. Jusqu’en 2012 on utilisait d’abord des nucléases dites à doigt de zinc, des méganucléases puis des nucléases de type activateur de transcription (2). Ces méthodes nécessitaient des opérations de biologie moléculaire et étaient longues et exigeantes en instruments et équipements spéciaux donc onéreuses.
Or, dans la nature, de nombreuses bactéries possèdent dans leurs génomes de longues séquences qui se répètent régulièrement appelées CRISPR (Clustered Regurarly Interspaced Short Palindromic Repeats). Ces séquences permettent aux bactéries de conserver la mémoire d’une infection par un virus pour s’en débarrasser lors d’une prochaine attaque.
En effet lors de l’infection par un virus, des séquences de celui-ci sont intégrées au sein des propres séquences CRISPR du génome de la bactérie. Lors d’une nouvelle infection, l’ADN viral au sein du CRISPR est recopié en ARN associée à la protéine Cas9 qui alors se fixe sur l’ADN du virus et l’inactive en le coupant (3).
Toute l’intelligence d’Emmanuelle Charpentier et de Jennifer Doudna a été de s’inspirer de ce mécanisme mis en jeu par des bactéries pour couper des brins d’ADN à un endroit précis du génome pour n’importe quelle cellule, comme un ciseau moléculaire. L’outil biologique est alors constitué d’une ARN guide associée à l’enzyme Cas9. Une fois l’ADN coupée on peut intervenir dans le système de réparation qui va recoller les deux extrémités du brin d’ADN soit :
- en ajoutant ou en enlevant des nucléides à chaque extrémité des morceaux du brin. On provoque alors une anomalie de la séquence cible, le gène devient alors inactif ou réparé.
- en ajoutant une séquence d’ADN synthétique (4) sur l’anomalie génétique repérée sur la séquence. Le système de réparation l’intègre au niveau de la coupure et le gène est corrigé et réparé.
Le schéma suivant résume assez bien l’opération. Cette méthode découverte par les deux chercheuses est précise, peu coûteuse et facile à mettre en œuvre, ce qui a permis à des milliers de laboratoires de l’utiliser dans le monde entier après 2015 car les applications sont nombreuses.

Sur les animaux, des chercheurs après identification des gènes responsables ont pu grâce à cette méthode augmenter la masse musculaire de chiens, créer des vaches laitières sans cornes.
Sur les végétaux par CRISPR on a créé des champignons de Paris qui ne brunissent pas lorsqu’on les coupe. On a aussi imaginé des plantes vivrières résistantes mieux à la sécheresse pour les pays chauds…
L’INSERM a ainsi travaillé sur les gènes d’anophèles pour donner une race de moustiques résistante au paludisme et qui en se multipliant ne peuvent plus transmettre ce fléau (5).
De nombreux chercheurs dont Jennifer Doudna ont attiré l’attention sur les problèmes éthiques posés par cette découverte qui peut multiplier à l’échelle de la planète les modifications génétiques. Déjà en Europe il y a une retenue générale sur les applications aux plantes « génétiquement modifiées ». Dans le monde il semble aussi y avoir un consensus sur les applications à l’homme et la recherche sur les fœtus. Plusieurs biologistes éminents se sont prononcés sur les dangers de modifier le patrimoine génétique germinal qui peut le transmettre à la descendance et toucher ainsi au patrimoine génétique de l’humanité. Pour l’instant, en 2020 Jennifer Doudna poursuit ses recherches à l’université de Californie à Berkeley et Emmanuelle Charpentier est directrice de l’Institut Max Planck « sur la science des pathogènes » à Berlin où elle continue ses recherches en biologie commencées à l’Institut Pasteur de Paris (1992-1995).
Jean-Claude Bernier
Octobre 2020
Pour en savoir plus
(1) La chimie dans les empreintes génétiques
(2) L’édition du génome : une révolution en marche
(3) Outils CRISPR pour étudier et combattre les bactéries pathogènes
(4) De la chimie de synthèse à la biologie de synthèse
(5) Les maladies tropicales négligées. Un modèle coopératif au service de l’innovation scientifique et médicale
Ciblage des défauts de réparation de l’ADN : nouvelles molécules et approches thérapeutiques utilisant la létalité synthétique
Manipulation génétique : des ciseaux moléculaires à double tranchant
Crédits : infographie © Ask Media pour le Parisien ; portraits © Nobel Media. III. Niklas Elmehed
Le prix Nobel de chimie 2020 a été attribué à Emmanuelle Charpentier et Jennifer Doudna pour la découverte des ciseaux à ADN Crispr-Cas9.
Pour découvrir cette méthode vous pouvez voir le reportage « Manipulation génétique : des ciseaux moléculaires à double tranchant » et l’article correspondant.
Pour approfondir les applications vous pouvez regarder les conférences suivantes ou lire les articles issus de ces conférences :
Entre la rentrée scolaire et la fête de la Science, la chimie bat son plein : en guise d’entrée en matière, Mediachimie vous propose une sélection de ressources ancrées sur l’actualité scientifique et économique, illustrant les nouvelles technologies de la recherche et l’industrie.
- Un éditorial sur les vaccins
- Une question du mois sur l’ozone
- Un zoom sur… la formulation des bétons et ciments
- Un dossier sur la quinine, découverte il y a 200 ans par P.J. Pelletier et J.B. Caventou par extraction de l’arbre quinquina
- les derniers colloques Chimie et… organisés par la Fondation de la Maison de la chimie : Chimie et nouvelles thérapies et Chimie et lumière
Vous trouverez également des ressources à destination des enseignants de tous niveaux :
- écoles et collège avec des séquences de la Main à la Pâte,
- collège cycle 4 avec la série Chimie et… en fiches collège, élaborée en partenariat avec le ministère de l’Éducation nationale
- lycée avec la série Chimie et… en fiches lycée, élaborée en partenariat avec le ministère de l’Éducation nationale
- lycée encore avec les dossiers pédagogiques élaborés en partenariat avec Nathan
- et une ouverture vers les métiers avec les Fiches orientation Nathan, et la série Les chimistes dans…
Le Grand Prix 2020 de la Fondation de la Maison de la Chimie a été attribué conjointement, en raison de l’impact de leurs travaux en sciences des matériaux polymériques,
au Professeur Guy BERTRAND
et au Professeur Krzysztof MATYJASZEWSKI.
Voir le communiqué de presse (PDF)
Le Grand Prix 2020 de la Fondation de la Maison de la Chimie a été attribué :
- au Professeur Guy BERTRAND, pour son travail sur la stabilisation d’espèces hautement réactives, en particulier les carbènes. Ces derniers ont en effet trouvé de nombreuses applications en chimie organique, inorganique et organométallique, ainsi que dans le domaine de la synthèse de polymères et de matériaux,
et
- au Professeur Krzysztof MATYJASZEWSKI, pour son travail sur les polymères et notamment sur la polymérisation radicalaire par transfert d’atomes qui a révolutionné la façon dont les macromolécules des polymères sont fabriquées.
Guy Bertrand, chimiste français, directeur de recherche de classe exceptionnelle du CNRS, est actuellement Professeur de chimie du Département de Chimie et Biochimie de l'Université de Californie, San Diego (La Jolla, Californie, USA).
Krzysztof Matyjaszewski, chimiste d’origine polonaise, est aujourd’hui Professeur de chimie à l’Université Carnegie Mellon (Pittsburgh, Pennsylvanie, USA).
Les annonces se sont multipliées cet été sur « les vaccins » contre la Covid-19 (1). Un vaccin américain promis en juin par Donald Trump avant octobre, l’homologation d’un vaccin russe annoncée en août par Vladimir Poutine… Sont sur les rangs 167 projets dont 30 sont en phase préclinique et 8 qui seraient dans les dernières phases de tests en Chine, aux États-Unis, au Royaume-Uni, en Russie. Ces annonces plus politiques que scientifiques montrent s’il en était besoin l’importance du challenge à la fois nationaliste et financier de cette course au vaccin.
Qu’est-ce donc qu’un vaccin ?
Un vaccin peut être une macromolécule chimique ou un produit d’origine biologique composé de plusieurs entités moléculaires.
Son objectif est de protéger d’une maladie les populations auxquelles il est administré. Ils font tous appel au même principe : stimuler les défenses immunitaires contre un agent infectieux en introduisant dans l’organisme cet agent ou une fraction de cet agent (un antigène) rendu inoffensif pour l’homme. C’est ce même principe qui permit à Edward Jenner en 1796 d’expérimenter sur un jeune garçon l’inoculation du pus d’une maladie de la vache « la vaccine » qui l’a protégé d’une maladie qui faisait des ravages depuis l’Antiquité « la variole » : la vaccine contenait un antigène bénin de la maladie qui tuait l’homme. Puis Louis Pasteur en 1880 fit un pas de plus en proposant « l’atténuation de la virulence » en laboratoire et l’a appliquée contre le charbon et la rage (2).
La mise au point et la fabrication d’un vaccin sont souvent longues et complexes avec un chemin marqué à chaque étape par les contrôles de qualité et de sécurité.
La substance active
Il faut produire un antigène (3) provenant du germe qui provoque la maladie, virus, bactérie ou parasite. Cet antigène va par la suite déclencher une réponse immunitaire par la synthèse de nouvelles molécules dirigées contre lui. Ces molécules, dites anticorps, sont produites par des cellules immuno-compétentes qui vont renseigner les caractéristiques de l’ennemi et mémoriser l’ensemble de ses caractéristiques. Ainsi en cas de nouvelle attaque l’ennemi est vite repéré, reconnu et neutralisé.
L’antigène peut être un germe vivant atténué (cas des vaccins contre les oreillons, la rougeole, la tuberculose) ou un germe ou une fraction de germe inactivé. Maintenant certains vaccins sont produits par génie génétique, ils sont appelés vaccins vivants recombinants (vaccin contre l’hépatite). Les gènes responsables du pouvoir pathogène sont inactivés ou éliminés. Les bactéries ou les virus sont alors inoffensifs mais reconnus comme identiques aux souches naturelles par le système immunitaire.
La fabrication du vaccin et la mise en forme pharmaceutique
La fabrication se fait selon les étapes suivantes. Il faut :
- caractériser le germe au sein d’une banque regroupant des virus ou des bactéries avec des propriétés constantes ;
- maitriser la culture et multiplier les germes grâce au contrôle des différents paramètres : durée, température, pression… ;
- récolter par extraction du milieu de la culture l’antigène ou tout facteur antigénique identifié ;
- purifier et concentrer en enlevant les impuretés à travers des procédés chimiques (extraction, centrifugation) ;
- inactiver la substance, en fonction des cas par la chaleur ou un agent chimique (par exemple le formaldéhyde – méthanal - qui supprime le pouvoir pathogène, en gardant la capacité à déclencher la réponse immunitaire ;
- utiliser des techniques de recombinaisons génétiques qui permettent aussi de susciter par le virus ou la bactérie des antigènes d’autres organismes. Le rassemblement des valences antigéniques dans un seul composé permet alors de vacciner contre plusieurs bactéries ou virus (cas du vaccin antipoliomyélite contre 3 types de poliovirus).
La mise en forme pharmaceutique passe par les étapes suivantes :
- assemblage des valences pour les vaccins combinés, comme le TABDT (typhoïde, paratyphoïde A et B, diphtérie et tétanos) ou le DT-Polio (diphtérie, tétanos, poliomyélite)
- formulation par ajout d’adjuvants pour améliorer l’efficacité et augmenter la réponse immunitaire (sels d’aluminium) et stabilisants (4). Cette étape est très critique dans l’ensemble du processus, car le vaccin préparé n’est pas forcément très immunogène, il doit être accompagné de substances capables de l’aider à déclencher une réponse immunitaire parfaitement maitrisée. Il faut savoir que la réponse immunitaire implique une coopération cellulaire. Elle est très dépendante des caractéristiques de chaque individu, d’où la difficulté de trouver un vaccin universel sans effets secondaires majeurs pour l’ensemble de la population ;
- répartition aseptique en flacon ou en seringue en milieu stérile ;
- lyophilisation pour enlever l’eau si nécessaire et obtenir une poudre ;
- conditionnement, étiquetage et mise en boite des lots qui peuvent représenter des millions de doses ;
- contrôle par l’industriel et une autorité indépendante et libération des lots ;
- livraison des lots en pharmacie, hôpitaux, centres de vaccinations.
Et pour la Covid-19 ?
il faut se rappeler ici que nous avons affaire à un virus et comprendre comment se font aussi les vaccins contre la grippe (5) causée par des virus de même genre, dits mixovirus. Chaque année des experts sélectionnent une collection d’agents infectieux qui varient d’une campagne à l’autre par mutations et constituent une banque de virus pathogènes. Les industriels cultivent alors ces virus sur des œufs de poules puis en extraient l’antigène ou des substances antigéniques, et les concentrent suivant les étapes de fabrication déjà décrites. La stratégie pour le coronavirus peut être la même en s’assurant que l’inactivation du virus sera stable.
L’autre stratégie consiste à se focaliser sur la protéine Spike cette fameuse « clé » qui se dresse autour de la sphère du coronavirus et qui se fixe sur les cellules nasales. Cette protéine peut être aussi synthétisée et produite par génie génétique (injection de l’ARN correspondante et production en masse de cette protéine d’intérêt) (6).
On dispose donc plusieurs stratégies : celle de la protéine recombinante (génie génétique) ou celle de l’extraction du virus de base.
Le groupe Sanofi Pasteur, un des leaders des vaccins contre la grippe et vaccins pédiatriques, mise comme pour la grippe sur ces deux aspects en association avec la société GSK (GlaxoSmithKline). Le vaccin semble être en phase de développement clinique, ce qui permettrait si tout se passe bien une mise sur le marché de plusieurs milliards de doses courant 2021. Il en est de même avec l’américain Translate Bio.
Il n’en reste pas moins vrai que la route avant la commercialisation est longue (7). Après les essais précliniques sur animaux, intervient la phase 1 où l’administration de doses est faite sur 10 à 100 personnes, puis l’administration concerne 50 à 500 personnes en phase 2 et lors de la troisième phase plusieurs milliers de personnes dans une zone où le virus circule activement. Déjà AstraZeneca a suspendu ses essais le 8 septembre à la suite de troubles graves sur certains patients au Royaume-Uni puis a pu reprendre les essais après quelques jours.
Le vaccin russe n’a pas encore entamé la phase 3, de même aux États-Unis. On ne sait pas grand-chose pour les vaccins chinois. C’est lors de la phase 3 que se manifestent les problèmes de sécurité et d’efficacité avec un lot de surprises. Les premiers à entrer dans la dernière phase ne seront pas forcément les premiers sur le marché et c’est encore là que se testeront les vaccins avec des efficacités plus ou moins bonnes.
Jean-Claude Bernier, Danièle Olivier et Constantin Agouridas
Octobre 2020
Pour en savoir plus
(1) Le coronavirus, un défi pour la chimie du vivant
(2) Pasteur et le vaccin contre la rage (vidéo)
(3) Immunoconjugués cytotoxiques, anticorps « armés » contre le cancer
(4) Les adjuvants aluminiques dans les vaccins
(5) Frimas, rhumes et grippes…
(6) L’innovation diagnostique au service des défis de la médecine personnalisée pour la prise en charge du sepsis et des maladies infectieuses
(7) La chimie dans la vie quotidienne : au service de la santé (Chimie et… junior)
Le prochain Village de la chimie aura lieu les 12 et 13 mars. Réservez la date !
En attendant vous pouvez retrouver les vidéos de l’édition 2020.
Le planning des ateliers du Village 2021 sera disponible courant décembre. Compte tenu de la situation sanitaire actuelle, les dispositions relatives à cet événement seront communiquées le plus rapidement possible.
Cette année 2020/2021, le partenariat entre La Fondation de la Maison de la Chimie et Les Éditions Nathan se prolonge pour proposer des ressources adaptées au programme de spécialités des terminales série générale et terminales STL et STI2S : voir le sommaire | télécharger le sommaire (PDF)
Les deux premiers dossiers pédagogiques de cette année traitent des points des programmes de 1re de spécialité et de 1re ST2S afin de revenir sur des thématiques et des sujets de la classe de 1re à approfondir en terminale.
- La lumière : couleurs et modèle ondulatoire – 1re de spécialité
- L’eau, une ressource essentielle à la vie – 1re ST2S
Si vous n’avez pas déjà eu l’occasion de les découvrir, vous pouvez parcourir :
- les dossiers disponibles en classes de seconde et de première
- les fiches orientation
- le sommaire des dossiers de l’année 2019/2020 (classes de seconde et première) : voir le sommaire | télécharger le sommaire (PDF)
À l’occasion du bicentenaire de la découverte majeure de la quinine extraite de l’écorce d’un quinquina par P.J. Pelletier et J.B. Caventou, Mediachimie vous invite à découvrir trois nouvelles vidéos de la série « Petites histoires de la chimie » :
- Le quinquina. I. La découverte
- Le quinquina. II. Les polémiques
- Le quinquina. III. La synthèse de la quinine
Ces vidéos complètent les anecdotes historiques publiées au printemps 2020 sur ce sujet :
- ACTE I : Le quinquina, remède du Nouveau Monde pour une maladie de l’Ancien : légendes et réalités d’une découverte
- ACTE II : Le quinquina, polémiques religieuses et querelles médicales
- ACTE III : Du quinquina à la quinine et à ses analogues ou du naturel au synthétique
et le quiz associé : La quinine et le paludisme