J’avais dans un premier temps voulu intituler cet édito une chimie pour s’envoyer en l’air mais des interprétations ambiguës pouvaient complétement dénaturer le propos. Il s’agit bien ici en 2024 de parler des épreuves olympiques qui permettent à certains athlètes de s’élever loin du sol et de vaincre la pesanteur pour établir un nouveau record. Deux épreuves retiennent notre attention, l’une discipline olympique depuis 1896 lorsque le baron Pierre de Coubertin l’introduit dans les premiers Jeux olympiques de l’ère moderne, le saut à la perche, l’autre plus récente intégrée aux Jeux de Sydney en 2000 est la version gymnastique d’un jeu de jardin, le trampoline.
Le saut à la perche
Utilisé dans la Grèce antique comme moyen pour franchir les ruisseaux à l’aide de longues tiges de bois on en retrouve trace dans des jeux irlandais vers 550 av. J.-C. sous forme de saut en longueur. Au XVIIIe siècle aux Pays-Bas, le Fierljeppen est un jeu consistant à franchir une rivière avec une longue perche de plusieurs mètres. Ce n’est que fin du XIXe siècle que les sauts en longueur laissent la place aux sauts en hauteur avec une impulsion du coureur vers le haut et non plus horizontale. Intégré dans les championnats anglo-saxons les règles s’imposent progressivement et en 1892 les championnats de France couronnent un stadiste avec un saut à 2,41 m. En 1896 c’est un Américain William Hoyt qui remporte la médaille d’or des premiers Jeux avec un saut à 3,30 m.
Commence alors la course aux matériaux pour la perche. Au départ perches en bois rigides peu flexibles puis en Bambou un matériau composite naturel (1) qui plie sans nécessairement se rompre. Viennent ensuite des alliages d’aluminium et de cuivre dont les coefficients d’élasticité ont été optimisés et enfin des perches en composites avec des nappes de fibres de verre cylindriques bien collées par des polyesters et mieux encore des fibres de carbone tressées et enserrées dans un polymère (2). Ces dernières perches peuvent se plier largement et se déplier en lançant l’athlète vers le haut. C’est très grossièrement un réservoir d’énergie car il s’agit bien dans cette compétition d’accumuler et de restituer le maximum d’énergie.
Pour un athlète de 80 kg et pour sauter à 5 m il faut 80 x 10 x 5 = 4000 J avec une seule impulsion. Un athlète capable de développer 1,3 kW en 0,3 seconde (saut à pieds joints) n’atteindra que 70 cm. Il faut donc une course d’élan qui va donner une énergie cinétique Ec = ½ mv2, une énergie potentielle de l’athlète capable avec les bras et les muscles des abdominaux de se retourner et de pointer vers la barre, Ep, et bien sûr l’énergie de flexion restituée par la perche vers le haut Ef.
L’équation totale est alors Etotale = Ec + Ep + Ef qui permet en une seconde d’atteindre la puissance (i) nécessaire pour sauter 5 m et plus. La perche en composite absorbe et restitue l’énergie comme un arc qui a été tendu et qui va lancer une flèche vers la cible. Les perches en composites doivent allier rigidité et flexibilité, elles ont une longueur comprise entre 5 et 6 m et pèse environ 20 kg (3). C’est pourquoi on voit au début de la course d’élan le sauteur porter la perche verticalement et l’abaisser progressivement avant de l’enfoncer dans le butoir et de donner son impulsion vers le haut. C’est un moment crucial car la propulsion doit être dirigée vers le haut et vers l’avant sinon le sauteur s’expose à un « retour piste » très dangereux car il retombe sur la piste et non sur les matelas de mousse en polyester de l’autre côté du sautoir. Discipline très exigeante, ce n’est que depuis 2010 que les recordmen tutoient les 6 mètres ; d’abord l’ukrainien Sergueï Bubka, puis le français Renaud Lavillenie et depuis 2023 Le Suédois Armand Duplantis à 6,23 m. Y a-t-il encore des degrés de progression ? Seuls l’entrainement et la recherche en matériaux nouveaux nous l’apprendront.
Le trampoline
C’est dans les années 1930 qu’un jeune américain Georges Nissen, en voyant au cirque les trapézistes se laisser tomber dans un filet, a l’idée de fabriquer un appareil qui leur permettrait de rebondir avec un tissu accroché à un cadre rigide par des ressorts. Avec trois amis il fait une tournée aux États-Unis et au Mexique pour populariser son invention qui est baptisée « el trampolin » en espagnol. C’est en 1941 qu’il crée la première société de fabrication des trampolines qui sont utilisés pour l’entrainement des pilotes, et c’est après 1950 que des épreuves de trampoline sont intégrées dans les compétitions universitaires d’athlétisme. Les premiers championnats du monde voient le jour en 1964 et en 1980 le trampoline est intégré comme sport de démonstration dans les Jeux olympiques et ne devient sport olympique qu’en 2000 aux Jeux de Sydney.
Le trampoline de compétition est constitué d’un cadre métallique de 4x2 m situé à 1,15 m du sol et entouré de matelas de mousse de polyester pour la sécurité des gymnases. Le tapis de sol est en polypropylène avec des mailles très serrées (260 g/m2) (4) accroché par des œillets métalliques au cadre par 120 ressorts en acier dur à teneur en carbone supérieure à 0,45% et souvent galvanisés (5). Les athlètes par impulsion sautent sur le tapis de saut qui avec les ressorts leur restituent de l’énergie et peut les propulser à chaque impulsion à plus de huit mètres en hauteur. Les acrobaties et figures dans les airs, sauts périlleux, retournés, rouleaux, etc. sont appréciés par un jury qui donne une note technique et artistique. Les champions olympiques 2020 sont Ie biélorusse Ivan Litvinovich et chez les femmes la chinoise Zhu Xueying. En 2024 la compétition doit se dérouler à l’Arena Bercy le 2 août. En fait c’est plutôt l’activité de loisirs qui a entrainé les compétitions. On trouve pour quelques centaines d’euros des trampolines de jardin de formes carrée ou circulaire avec un tapis de saut protégé par des coussins et un filet de protection pour la sécurité des enfants. Les salles de sport ont aussi installé des « jumping fitness » où il s’agit de faire des exercices de sport sur trampoline, une séance de 15 minutes remplaçant le jogging.
Dans ces deux sports, le saut à la perche et le trampoline, les forces musculaires alliées à la technologie des matériaux sont une belle démonstration de l’énergie déployée, conservée et amplifiée, non seulement pour atteindre des records mais pour décrire des trajectoires et sauts de toute beauté.
Jean-Claude Bernier
janvier 2024
(i) La puissance est l’énergie libérée pendant un certain temps.
Pour en savoir plus
(1) Les matériaux composites dans le sport,Y. Rémond et J.-F. Caron, in La chimie et le sport (EDP Sciences, 2011) isbn : 978-2-7598-0596-9
(2) Les matériaux de la performance, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, in La chimie dans le sport, collection Chimie et... Junior (EDP Sciences, Fondation de la Maison de la Chimie, 2014), isbn : 978-2-7598-1238-7
(3) Les matériaux dans le sport, (r) évolutionnaires !, P. Bray, O. Garreau et J.-C. Bernier, Fiche Chimie et... en fiches (Mediachimie.org)
(4) Les textiles et les vêtements pour le sport, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, in La chimie dans le sport, collection Chimie et... Junior (EDP Sciences, Fondation de la Maison de la Chimie, 2014), isbn : 978-2-7598-1238-7
(5) Corrosion des métaux et protection, D. Soissons, Dossier pédagogique Nathan / Mediachimie (Mediachimie.org)
Crédits illustrations : Perche par andreas N / Pixabay ; Trampoline, Finale Jeux olympiques de la jeunesse d'été de 2018, Martin Rulsch, CC BY-SA 4.0, Wikimedia Commons
Dans les compétions sportives, les résultats dépendent autant des performances du corps (énergie musculaire) que de la volonté de gagner (chimie de notre cerveau) et de la qualité technique du matériel utilisé.
Mediachimie vous propose une page dédiée à la chimie et au sport avec une sélection de ressources pour découvrir et comprendre pourquoi la chimie occupe une place si importante dans le domaine du sport de haut niveau.
Ne ratez pas le prochain Colloque de la Fondation « Chimie et sports en cette année olympique et paralympique » qui se tiendra le mercredi 7 février 2024.
Afin de préparer votre venue, nous vous proposons de tester vos connaissances ainsi que celles de vos élèves au travers d’un quiz « sport et chimie » ludique et instructif.
Réservez votre journée du mercredi 7 février 2024 pour participer au colloque accessible au grand public à la Maison de la Chimie.
Colloque Chimie et Sports en cette année olympique et paralympique
Mercredi 7 février 2024
Maison de la Chimie, 28 bis rue Saint-Dominique, 75007 Paris
Le sport de haut niveau est vu comme un laboratoire de la performance humaine en cette année olympique 2024. Sachant que la performance sportive dépend des facteurs physiques, psychologiques et techniques, l’amélioration de ces trois facteurs est activement recherchée via : les matériels, les matériaux, les sciences médicales, l’entrainement, la diététique et la préparation mentale. La Chimie est partout présente. Notre corps lui-même est une usine chimique fascinante dans laquelle les relations entre la performance sportive, la biologie et la santé sont étroites. Mais si la chimie de notre corps peut apporter le meilleur, certains excès peuvent apporter le pire et la traque aux molécules dopantes ou simplement nocives est un véritable défi.
La chimie de notre corps ou celle des matériaux de la performance contribue à repousser les limites des possibilités physiologiques et le sport illustre la vision très contemporaine que l’espoir d’une bonne santé et d’une longue vie dépend fortement de l’entretien sportif de notre corps.
Les thèmes traités dans ce colloque intéressent donc tous les citoyens de toutes les générations et pour vous informer avec rigueur et objectivité, nous avons fait appel à des experts du sport et aux experts scientifiques universitaires et industriels des disciplines concernées.
Danièle Olivier
Vice-Présidente de la Fondation de la Maison de la Chimie
Téléchargez le programme (PDF)
Inscription gratuite et obligatoire : INSCRIPTIONS
Afin de préparer votre venue, nous vous proposons de tester vos connaissances ainsi que celles de vos élèves au travers d’un quiz « chimie et sports » ludique et instructif.
Ajout du 10/02/2024 : La captation du colloque du colloque est disponible sur Mediachimie ou sur Youtube ainsi que sur Viméo.
Conception graphique : CB Defretin | Images : © peopleimages.com – © skampixelle – © aАлексей Коза – © Danijela – © MarekPhotoDesign.com / Adobe Stock – © Arkema – © Paris 2024
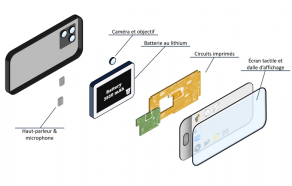
Vous avez peut-être reçu en cadeau le dernier bijou électronique qu’est votre smartphone. Mais savez-vous que c’est un condensé de chimie au sein d’un assemblage très complexe souvent comparé à un mille feuille ?

Figure 1. Structure en mille feuille. Source : capture de la vidéo La chimie cachée du smartphone ! (Blablareau au labo)
L’écran tactile qui permet à vos doigts de sélectionner des lettres sur le clavier, agrandir les images, bref en un mot à « cliquer » … est constitué d’un verre résistant à base d’aluminosilicate(i) avec un peu d’oxyde de potassium pour limiter les fissures superficielles. En plus petites quantités il contient également des éléments chimiques qui contribuent par exemple à la vivacité des couleurs de l’affichage comme le lanthane (La) ou d’autres qui limitent l’émission de lumière UV.
Derrière l’écran tactile se trouve la dalle d’affichage qui permet à l’écran d’être lumineux et de reconstituer de très belles images colorées. La dalle est caractérisée par un très grand nombre de pixels (en moyenne 2,5 millions). A chaque pixel est associée une couleur qui sera émise grâce à des LED ou des OLED(ii) selon le type de votre smartphone. De nombreuses terres rares telles que Ytrium (Y), Lanthane (La), Terbium (Tb), Thulium (Tm), Praséodyme (Pr), Europium (Eu), Dysprosium (Dy), Gadolinium (Gd) et Cérium (Ce) sont utilisées sur l’ensemble des dalles d’affichage LCD et OLED.
Pour continuer la description du mille-feuille, il y a plusieurs cartes de circuit imprimés où sont soudés les circuits intégrés et les processeurs, les « cerveaux » du smartphone. Ceux-ci sont constitués de milliers de transistors contenant les puces qui commandent les fonctions de votre appareil. Les éléments chimiques qui s’y trouvent peuvent être regroupés selon la fonction à laquelle ils contribuent.
Le câblage nécessite du cuivre (Cu), de l’argent (Ag), de l’or (Au) et du tantale (Ta).
Pour le microphone il faut du nickel (Ni) et des terres rares telles que du dysprosium (Dy), du praséodyme (Pr), du terbium (Tb), du néodyme (Nd) et du gadolinium (Gd).
Les puces ont besoin de silicium (Si) ultrapur dans lequel est incorporé en quantités infinitésimales de l’antimoine (Sb), de l’arsenic (As), du phosphore (P) et du galium (Ga). On parle de dopage du silicium.
Et le tout doit être soudé, le plus souvent avec un mélange étain, plomb (Sn, Pb), ou pour les soudures sans plomb avec un mélange étain, cuivre, nickel (Sn, Cu, Ni) et plus rarement car très coûteux avec un mélange étain argent cuivre (Sn, Ag, Cu).
Tout cela ne peut pas fonctionner sans une batterie performante, puissante et légère. Actuellement vos smartphones possèdent des batteries lithium-ion dont la cathode contient les éléments lithium (Li), cobalt (Co), manganèse (Mn) et nickel (Ni) et l’anode du carbone graphite. L’électrolyte contient des composés organiques et des sels à base de lithium, phosphore et fluor(iii).
La majorité des boitiers est en matière plastique, donc à base de carbone et d’hydrogène, dans lequel un peu de brome (Br) est présent pour jouer le rôle de retardateur de flamme. Des composés à base de nickel sont également incorporés pour limiter les interférences électromagnétiques. Dans certains cas les boitiers sont en alliage de magnésium.
Alors oui la liste des éléments chimiques présents dans un smartphone est longue et on estime qu’elle représente environ la moitié de la classification périodique !
Beaucoup de ces éléments sont devenus des matériaux critiques soit parce qu’ils sont en quantité limitée sur la planète ce qui conduira à un épuisement de la ressource non renouvelable, soit que leurs disponibilités, leurs répartitions et leurs accès rencontrent des problèmes de géopolitique. Sans compter certaines conditions d’extraction dans quelques pays qui soulèvent de véritables questions éthiques.
Les procédés d’extraction et de purification sont consommateurs d’énergie et pour certains, sources de pollution. Il faut donc impérativement améliorer toutes les étapes.
Enfin le smartphone aura fait environ 4 fois le tour de la terre avant de vous être vendu entre l’extraction des matières premières, la fabrication des principaux composants, l’assemblage et la distribution, toutes ces étapes ne se faisant pas dans les mêmes pays (fig. 2). Donc son bilan carbone est très mauvais.

Figure 2. Source : Les défis du CEA #244 : les matériaux critiques, Smartphone, une mine urbaine, p.27
Alors prenez en soin et utilisez le plus longtemps possible votre smartphone, changez la batterie quand elle devient défaillante, faites réparer quand c’est possible avant de décider d’en changer.
Et alors ne jetez pas votre smartphone. Plusieurs solutions existent : il peut être reconditionné ou subir des transformations pour récupérer les matières premières.
Pour cela apporter le dans le bac de récupération des objets électroniques soit de votre déchetterie soit dans les bacs dédiés en ville ou via le circuit de récupération « ecosystème »(iv).
On en est qu’au début mais le recyclage devient impératif(v).
À ce jour certains matériaux présents dans les cartes électroniques comme l’or l’argent et le cuivre sont récupérés car ils ont une haute valeur marchande. Les coques en plastique sont incinérées. Mais il faut mettre en place le développement du recyclage des autres et tout particulièrement des terres rares et du lithium.
Les procédés sont difficiles à mettre en place compte tenu de la complexité du produit dont on part mais cela avance.
Donc plus il y aura de smartphones mais aussi de tablettes récupérées, plus cela deviendra une mine de seconde main, et plus les procédés de recyclage pourront trouver une base économique viable.
Un beau défi pour les chimistes !
Françoise Brénon
(i) Les verres en aluminosilicates contiennent des oxydes de silicium et d’aluminium (SiO2 et Al2O3). L’oxyde de potassium a pour formule K2O.
(ii) Il y a deux types de smartphones sur le marché soit à cristaux liquides (LCD) soit à AMOLED. Les smartphones dit à cristaux liquides utilisent des LED et les autres smartphones dit à AMOLED utilisent des OLED. LED est le sigle anglais pour diode électroluminescente. OLED est le sigle anglais pour diode organique électroluminescente
(iii) LiPF6
(iv) ecosystem je donne mon téléphone
(v) Pour en savoir plus aller voir la conférence en ligne Le recyclage des terres rares : une stratégie d’approvisionnement à la taille de leurs enjeux du colloque « Chimie, Recyclage et Économie circulaire » du 8 novembre 2023
Pour en savoir plus
La chimie cachée du smartphone ! (vidéo) R. Blareau et F. Brénon. Mediachimie / Blablareau au labo. Les fonctionnements des écrans tactiles et de la dalle d’affichage à Amoled y sont décrits en détail en plus des diverses compositions chimiques.
Exploser un smartphone, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, in La chimie dans les Technologies de l'Information et de la Communication, collection Chimie et junior Mediachimie – EDP Sciences (page 56 et suivantes). Entre autres, le fonctionnement des smartphones à cristaux liquides (LCD) y est détaillé.
Accumulateur lithium-ion : une révolution technologique portable ! (vidéo) R. Blareau et F. Brénon, Mediachimie / Blablareau au labo
Garder son smartphone le plus longtemps possible , sur le site de l'ADEME
Zoom sur Les progrès de l’optoélectronique : des LED aux OLED, J.-P. Foulon (Mediachimie.org)
Pour les problématiques et les solutions liées au recyclage : Colloque Chimie, Recyclage et Économie circulaire du 8/11/2023 à la Fondation de la maison de la chimie
Pour les problématiques relatives aux matériaux critiques : Colloque Chimie et Matériaux stratégiques de novembre 2022 à la Fondation de la maison de la chimie
Des températures anormalement élevées cet automne en France, des précipitations fortes et continues en Europe en novembre, des cyclones à répétition dans le Pacifique Sud m’ont fait consulter les relevés de température globale de la moyenne atmosphère des organismes américains utilisant les satellites depuis 1979 (figure 1) (1).
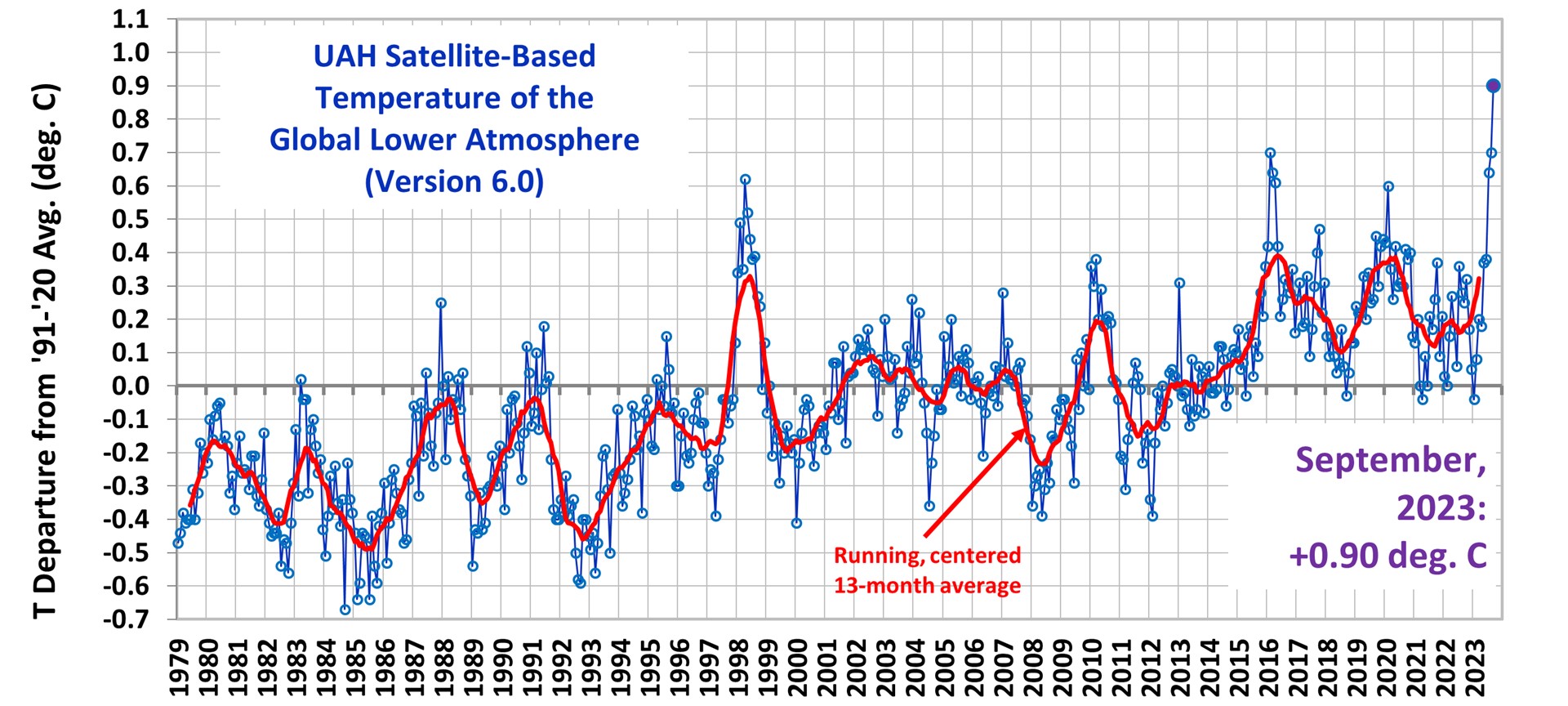
Figure 1. Température de la basse atmosphère au niveau mondial basée sur le satellite UAH, jusqu'en septembre 2023
J’ai été surpris par le pic détecté pour octobre 2023 à plus de +0,91°C, bien au-delà du record relevé en 1998 de +0,6°C. D’après les climatologues ce serait dû à des phénomènes de dynamique des océans et en particulier de l’océan Pacifique. Je me suis alors rappelé un séjour au Chili invité par des collègues universitaires à Santiago et à Valparaiso. C’était une visite de l’École supérieure de la pêche dans cette dernière université où j’ai vu des écrans Sonar montrant l’abondance de bancs de poissons le long des côtes Ouest de l’Amérique du Sud attirés par la remontée d’eaux froides. On m’avait alors expliqué les phénomènes climatiques « la Niña » et « el Niño ». Depuis, ces deux manifestations de la dynamique des océans et leur influence sur le climat de la planète « La Niña » et « el Niño » ont eu les honneurs de la presse mondiale qui en a constaté leurs influences (2) sans que les scientifiques en comprennent bien les origines.
La Niña
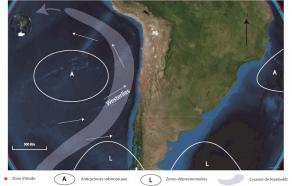
Dans une situation normale dans le Pacifique Sud les alizés du sud-est sont bien établis autour de l’anticyclone de l’île de Pâques. Ces vents réguliers soufflent d’est en ouest entrainant les eaux chaudes de surface vers l’ouest. Ce déplacement provoque une remontée des eaux profondes froides à l’est du Pacifique le long des côtes du Pérou et du Chili et apparait au sud de l’équateur une langue froide. Ces eaux froides plus riches en nutriment à l’est attirent les bancs de poissons à la grande satisfaction des pêcheurs sud-américains. À l’ouest les eaux de surface sont plus chaudes et l’évaporation conduit à des précipitations plus abondantes vers l’Indonésie jusqu’au nord de l’Australie. Si la Niña se prolonge, elle peut entrainer des inondations dans ces pays (figure 2).

Figure 2. Conditions La Niña, superposée sur la carte des anomalies de température moyenne de surface de la mer. En orange les zones de réchauffement de la surface de la mer, en bleu-vert les zones plus froides. Dessin NOAA Climate.gov de Fiona Martin.
El Niño
Lors d’un épisode El Niño les hautes pressions de l’anticyclone de l’île de Pâques faiblissent, les alizés s’arrêtent voire s’inversent, les eaux chaudes refluent vers l’est avec leurs cortèges de nuages chargés d’eau, les tempêtes et les ouragans apparaissent bien plus à l’est et affectent la Polynésie française et les côtes du Pérou avec de fortes précipitations qui provoquent des inondations et des glissements de terrain.
De plus, le long des côtes les eaux chaudes plus pauvres en nutriments n’attirent plus les poissons au grand dam cette fois des pêcheurs péruviens et chiliens (3). Au contraire à l’ouest, le temps est bien plus sec et lors d’épisodes El Niño des incendies peuvent frapper l’Indonésie et l’Australie (figure 3).
Le nom El Niño a été donné à ce phénomène par les pêcheurs qui l’ont observé, car il apparaissait à son maximum souvent en décembre par référence au « petit garçon » ou « El Niño de Navidad », l’enfant Jésus célébré à Noël.

Figure 3. Conditions El Niño, superposée sur la carte des anomalies de température moyenne de surface de la mer. En orange les zones de réchauffement de la surface de la mer, en bleu-vert les zones plus froides. Dessin NOAA Climate.gov de Fiona Martin.
Les oscillations océaniques et le climat
Ces phénomènes couplés Océan /Atmosphère appelés ENSO (El Niño Southern Oscillation) par les météorologues dépendent principalement de la température des eaux de surface du Pacifique. Plus la température est élevée plus l’évaporation (4) est forte. A 15°C un m3 d’air au-dessus de la surface contient 13 g d’eau, à 26°C c’est presque le double (24 g/m3). D’où les fortes précipitations, la formation d’orages et un excédent de cyclones majeurs sur l’ensemble du Pacifique.
Dans le dernier épisode intense de El Niño de 1997/98, 18 cyclones y avaient été observés alors qu’en 1999 avec la Niña seuls 7 cyclones avaient été recensés sur l’ensemble de l’océan Pacifique. Ce phénomène se reproduit régulièrement avec une périodicité de 2 à 7 ans. Sont alors libérées davantage d’humidité et de chaleur dans l’atmosphère (5) ce qui conduit à une hausse des températures mondiales comme en 1998 et 2016 qui donnèrent des températures globales jusque-là jamais enregistrées. El Niño qui a commencé cet été et qui atteint son maximum en décembre est bien parti avec le réchauffement climatique (6) pour battre le record de température mondiale en 2023.
Ces oscillations océaniques font partie des phénomènes météorologiques encore peu expliqués, comme le « jet-stream » qui est un courant d’air se déplaçant à grande vitesse à haute altitude entre la troposphère et la stratosphère d’ouest en est et qui est mis à profit par les compagnies aériennes transatlantiques pour gagner du temps et économiser le carburant entre l’Amérique et l’Europe.
El Niño a semble-t-il aussi un effet sur ces jet-streams ; les précipitations augmentent en Californie et le courant jet polaire se déplace plus au sud. Ces courants d’air notamment en Atlantique Nord accompagnent aussi les tempêtes sur le « rail des dépressions » qui nait près de Terre-Neuve et lors des hivers doux et humides suit le 50° parallèle jusqu’aux Îles Britanniques et nos régions du Nord-Ouest.
Les météorologues suivent attentivement ces phénomènes planétaires et peuvent par exemple pour la France donner des tendances à 3 mois avec des probabilités pour cet automne à 70% plus chaud et à 50% plus humide que les normales.
Des études supplémentaires seront encore nécessaires pour expliquer tous ces phénomènes climatiques et les prévoir. La nature reste difficile à modéliser !
Jean-Claude Bernier
Novembre 2023
(1) UAH satellite based temperature of the global lower atmosphere, thru September 2023, site Dr Roy Spencer’s Global Warming Blog
(2) L’augmentation de température, Les conséquences du réchauffement climatique (vidéo) CEA 2015
(3) Une chimie de la mer pour l’avenir de la terre, E. Durocher, J.-P. Labbé, J.-C. Bernier, Fiche Chimie et... en fiches (Mediachimie.org)
(4) Changements d’état (vidéo) Palais de la découverte, hébergé sur le site www.canal-u.tv
(5) Chimie, atmosphère et climat, E. Durocher, J.-P. Labbé, J.-C. Bernier, Fiche Chimie et... en fiches (Mediachimie.org)
(6) Le changement climatique, C. Agouridas, J.-C.Bernier, D. Olivier et P. Rigny, La chimie, l'énergie et le climat, collection Chimie et... Junior, EDP Sciences, Fondation de la Maison de la Chimie (2017)
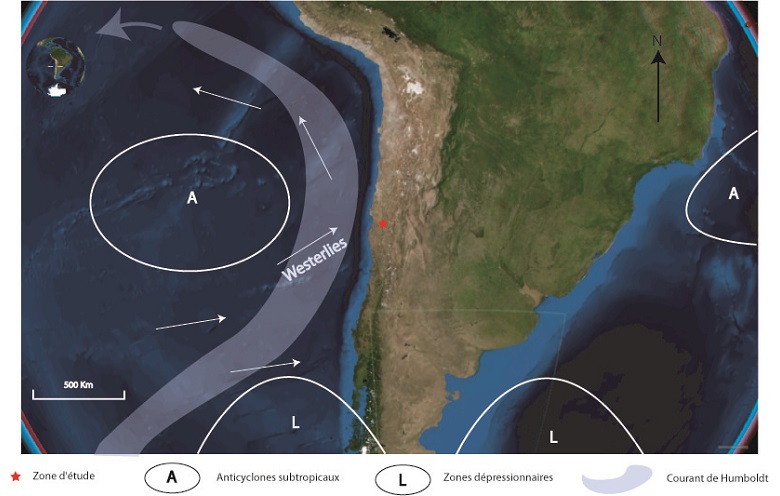
Circulation atmosphérique dans le Pacifique Sud au large du Chili : localisation des masses anticycloniques (A) et dépressionnaires (L), Isostasie123 - travail personnel, Wikimedia Commons (licence CC BY-SA 3.0)
Les radicaux sont des espèces chimiques possédant au moins un électron non apparié. La spectroscopie paramagnétique électronique (RPE) permet de détecter ces espèces radicalaires.[…]
Accédez au Zoom sur Les radicaux : quelques aspects particuliers…
Biochar est un mot résultant de la contraction en anglais de « biocharcoal » qui désigne un charbon d’origine végétale.
Le biochar est proposé pour l’amendement des sols afin d’en augmenter les qualités et les rendements des productions agricoles.
Le biochar est issu de la biomasse provenant de déchets de bois formulés sous forme de pellets et non issue de la coupe de bois, ce qui évite les déforestations provoquées pour l’obtention traditionnelle du charbon de bois.
Le biochar est produit par pyrolyse de ces déchets, procédé qui consiste en un chauffage modéré entre 250°C et 650°C en l’absence de dioxygène. Il en résulte la production de produits gazeux (méthane et dihydrogène utilisables comme combustibles) mais aussi des produits liquides (hydrocarbures à usage de biocarburant) et d’un composé solide noir qui est le biochar. C’est un procédé sans émission de CO2, qui a été mis au point depuis une douzaine d’années à la suite des travaux de l’équipe Lehmann de l’Université Cornell à Ithaca dans l’état de New York.
La pyrolyse lente vers 350°C conduit à une formation à 35 % de biochar et 10 % de gaz (i). Ainsi il faut presque 4 tonnes de déchets de bois à 75 % de matière sèche pour produire 1 tonne de biochar avec une pureté pouvant atteindre 90 %, qui dans ce cas est appelé le biochar premium.
L’entreprise Pronatura a mis au point une technologie permettant aux machines actuelles de fonctionner 7 jours sur 7 et 24h sur 24 et de produire de 1 à 5 tonnes de biochar par jour. Le rendement (masse de biochar / masse de la biomasse à 15 % humidité) peut atteindre 45 %.
La porosité du biochar obtenu lui confère une surface spécifique (ii) de 420 m2/g qui conduit à de grandes capacités d’adsorption : c’est en quelque sorte un réservoir qui peut stocker jusqu’à deux fois et demie son volume en eau ! Quand la plante a besoin d’eau, pendant les périodes de sécheresse, elle ira la chercher dans ce que le biochar a stocké. Par ailleurs le biochar, en présence d’eau, donne un pH basique (entre 7 et 10) ce qui peut permettre de rééquilibrer l’acidité des sols.
Les effets de l’utilisation du biochar sur les augmentations de rendement concernant les cultures dans les zones tropicales comme celles des zones tempérées sont considérables : tomates +177 %, coton +100 %, maïs +150 %, blé +170 % par exemple !
Des startups sont actives sur ce secteur, en particulier « NetZero » cofondée par le climatologue Jean Jouzel.
La société Terra Fertilis à Argentan, dans l’Orne, est la seule entreprise en France à bénéficier d’une autorisation de mise sur le marché délivrée par l’ANSES : plusieurs villes en achètent pour leurs espaces verts, tout comme des pépiniéristes ainsi que des maraîchers et de nombreuses coopératives agricoles qui manifestent de plus en plus d’intérêt pour la culture du maïs et de la betterave.
Mais le biochar est aussi une solution pour la séquestration à long terme du carbone : une tonne de biochar stocke jusqu’à 3 tonnes de CO2. Actuellement le prix de revient du biochar varie entre 500 et 1000 € la tonne. La valorisation en crédits carbone peut alors être estimée à 300 € /ha. Ceci montre que l’intérêt économique dépend essentiellement du montant des crédits carbone (actuellement fixé à 40 € la tonne de carbone).
Les perspectives de l’utilisation du biochar sont nombreuses en dehors de l’agriculture. Par exemple les producteurs de silicium remplacent le charbon par du biochar dans la réduction industrielle de la silice, SiO2 + C = Si + CO2, ce qui conduit à un bilan carbone neutre car le carbone du biochar provient du bois.
Enfin, la Société Soler qui a deux usines dans l’Aube et une autre en Gironde est le leader en France de la production de biochar avec plus de 50 000 tonnes dans un marché national de 130 000 tonnes.
Il ne faut pas confondre le biochar avec le noir de carbone qui sert actuellement essentiellement à l’industrie des pneumatiques.
Et ne broyez pas du noir !
Jean-Pierre Foulon et l’équipe question du mois
(i) Il s’agit de pourcentage en masse.
(ii) La surface spécifique d’un matériau traduit sa capacité à fixer à l’échelle microscopique des molécules à sa surface. Exprimée en m²/g, c’est la surface disponible par unité de masse du matériau.
Pour en savoir plus :
Site Pleinchamp : Tout savoir ou presque sur le biochar (2023)
Site de Pro-Natura International : le biochar est un intrant qui augmente les rendements agricoles de manière écologique en séquestrant du carbone (2019)
Rapport du GIEC (2022) : Mitigation of climative change (chapitre 7)
Pour rappel
Un charbon très tendance, Jean-Claude Bernier, éditorial du 23 mai 2016 (Mediachimie.org)
Crédit illustration : Biochar après production, Oregon Department of Forestry FlickR, CC BY 2.0, Wikimedia commons
Le dernier rapport de l’agence Internationale de l’Energie (AIE) attire notre attention sur le problème des réseaux électriques (1) qui sans nouveaux investissements et développements de réseaux intelligents vont bloquer les transitions énergétiques. En effet, les transitions énergétiques en Europe et dans le monde s’appuient entre autres sur une électrification bas carbone. L’électricité va remplacer le gaz, elle va propulser les voitures particulières et les camions, les projets hydrogène vont multiplier les électrolyseurs, les champs d’éoliennes off-shore en mer et les fermes photovoltaïques dans les déserts exigent des liaisons et de longs réseaux fiables et intelligents (2).
Il existe au niveau mondial 80 millions de kilomètres de lignes dont 7% pour le transport longue distance (THT 400 kV et HT 225 kV)* et 93% pour la distribution (MT 15 à 30 kV et BT 400 et 240 V)* au total cela représente plus de 100 allers -retours terre – lune ! Pour la France on identifie environ 100 000 km de lignes HT et environ 580 000 km de lignes MT et 650 000 km de lignes BT dont à peu près 213 000 km souterraines.
La transition énergétique va augmenter l’électrification bas carbone du chauffage, de l’industrie, du transport (3). Dans la consommation finale d’énergie mondiale, l’électricité qui représentait 21% en 2022, devrait monter jusqu’à 35% en 2050. D’où le risque de ne pouvoir faire face à ces progressions si on ne peut relier par un conducteur la production d’électricité au consommateur. L’Allemagne s’est trouvée dans ce cas où sa production éolienne basée prioritairement dans le nord ne pouvait être acheminée dans les zones de consommation du sud. On peut ajouter que, dans les pays européens où la densité de population est plutôt forte, l’implantation d’une ligne haute tension (225 kV) peut prendre 6 à 12 ans pour obtenir les permis et être construite. C’est bien plus rapide en Chine et en Inde.
Les conducteurs
L’AIE estime vital de construire et rénover environ 80 millions de kilomètres de réseau, c’est-à-dire l’équivalent du réseau actuel qui serait doublé d’ici 2040. C’est demander le doublement des investissements actuels et aussi des ressources en matériaux.
En effet, quels sont les matériaux nécessaires pour acheminer l’électricité de la centrale à votre prise de courant ? Les grands spécialistes des câbles font appel à deux bons conducteurs : le cuivre Cu de conductivité ρ = 59 106 S.m-1 l’Aluminium Al ρ = 37 106 S.m-1. L’aluminium est moins bon conducteur mais il est plus léger d=2,7 que le cuivre d= 8,9 et d’autre part les prix sont nettement différents 8 €/kg pour le cuivre et 2 €/kg pour l’aluminium. C’est pourquoi les alliages d’aluminium comportant comme additifs Mg et Si, parfois renforcés acier, sont utilisés pour les lignes aériennes HT, dites de transport, alors que le cuivre est plus utilisé pour les lignes basse tension (BT) dites de distribution et les lignes enterrées ou sous-marines (4).
Y aura-t-il suffisamment de métaux pour conduire cette (r)évolution ?
Le calcul est complexe : plus la tension est forte moins la section du câble est grande pour une puissance délivrée et donc le poids de conducteur par kilomètre est plus faible (5).
Pour le transport en haute tension par voie aérienne en fil d’aluminium il faut : 11 kg/Mw/km alors que pour la distribution en basse tension il faut 65 kg/Mw/km. Pour des conducteurs en cuivre il faut entre 101 kg/Mw/km et 438 kg/Mw/km suivant le transport ou la distribution de l’électricité. Une extrapolation sur les 88 millions de km de lignes à doubler dont 7% pour le transport et 93% pour la distribution donne respectivement 62 000 tonnes et 4,86 Mt d’aluminium et si la moitié de la distribution en basse tension est faite avec le cuivre il en faut 16,3 Mt.
Rappelons que les productions mondiales sont 67 Mt pour Al et 26 Mt pour le Cu. Pour la France on compte 100 000 km de lignes haute tension gérée par RTE, 586 000 km de moyenne tension (15-30 kV) et 650 000 km de basse tension (400 et 230 V) dont 230 000 km enterrées gérées par EDF. L’estimation des besoins en conducteur conduit à environ 40 000 tonnes d’Al et 286 000 tonnes de Cu s’il fallait doubler le réseau. Notons que dans l’infrastructure d’un réseau il y a aussi les pylônes (6) qui supportent le poids des lignes, ils sont environ 100 000. Ils peuvent atteindre 90 mètres en acier avec une dizaine d’isolateurs en céramique pour la THT. Ils relient entre eux les nœuds de connexion et surtout les postes de transformateurs HT /BT qui comportent des tonnes d’acier spéciaux fer silicium (3%) à grains orientés et à forte perméabilité magnétique, leur nombre est d’environ 4000 en France. D’ailleurs Enedis envisage de doubler ses investissements à 5,5 Mrds € par an comme RTE d’ici 2040 approchant des 10 Mrds € annuels pour le réseau électrique, coûts cachés de la transition.
Et la chimie où est-elle ?
Elle est déjà bien présente dans la chimie métallurgique de préparation de l’aluminium et du cuivre de qualités électriques, mais si vous avez déjà épluché un fil électrique vous avez constaté qu’autour de l’âme en cuivre une enveloppe plastique (7) jouait un rôle de protection et d’isolant. On utilise le polyéthylène pour les THT et HT, il peut être réticulé si on cherche une bonne résistance au froid (lignes de montagne). Les copolymères éthylène /propylène sont plus utilisés pour les moyennes et basses tensions. Les couches de caoutchouc et silicones qui ont de très bonnes résistances aux basses et hautes températures sont souvent présentes pour les câbles enterrés ou sous-marins.
Dans les transformateurs, outre les papiers siliconés de l’isolation, on trouve les huiles isolantes qui servent aussi de fluide caloporteur jusqu’aux radiateurs externes pour éliminer la chaleur due aux effets Joule et aux pertes par courants de Foucault. Ces huiles autrefois à base de PCB (polychlorobiphényle) remarquablement stables mais toxiques pour l’environnement ont été remplacées par des huiles mélangeant naphtènes (aromatiques) et alcènes à haut point éclair pour éviter les incendies.
Le prix des conducteurs, des isolants plastiques, des aciers à grains orientés (GO), des pylônes, des moyens de construction a explosé en 10 ans. Alors que les investissements dans les énergies renouvelables ont doublé en 10 ans, ceux en faveur des réseaux électriques sont restés stables. On a augmenté le volume du liquide dans le réservoir mais on n’a pas changé le petit robinet. Faute de prévision et dans un contexte de sous-investissement dans les réseaux s’est créé un goulot d’étranglement et on entre en dépendance du gaz et du charbon à la merci de coupures de courant dont l’impact économique est encore bien plus grand.
Jean-Claude Bernier
novembre 2023
*Très Haute Tension THT, Haut Tension HT, MT Moyenne Tension, BT Basse Tension
Pour en savoir plus
(1) Electricty grids and secure energy transitions (AIE) Octobre 2023
(2) Réseaux de transport de l’électricité et transition énergétique de S. Henry, article et conférence, Colloque Chimie et enjeux énergétiques, Fondation de la Maison de la chimie (2012)
(3) Le transport ou le stockage de l’énergie électrique, de C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, in La chimie, l’énergie et le climat, collection Chimie et... Junior, EDP Sciences, Fondation de la Maison de la Chimie (2014), ISBN : 978-2-7598-2098-6 (2014)
(4) Câble High-Tech en PACA (vidéo, Des Idées plein la tech’) Virtuel / Universcience / Fondation Internationale de la Maison de la Chimie
(5) Les métaux stratégiques pour l’énergie, de B. Goffé, article et conférence, Colloque Chimie et enjeux énergétiques, Fondation de la Maison de la chimie (2012)
(6) Zoom sur quelques aspects de la corrosion des ouvrages d’art, de J.-P. Foulon, Zoom sur… Mediachimie.org
(7) Polymères stratégiques, sensibles pour l’industrie : bioressources, recyclage, quelle stratégie ?, de D. Bortzmeyer, article et conférence, Colloque Chimie et matériaux stratégiques, Fondation de la Maison de la chimie (2022)
Crédit illustration : Lignes à haute tension (Sagy, Val d'Oise), France, Spedona/JH Mora, travail personnel / Wikimedia Commons (licence CC BY-SA 3.0)
Les vidéos et résumés des conférences du colloque Chimie, recyclage et économie circulaire du 8 novembre 2023 sont disponibles sur Mediachimie et sur Youtube ainsi que sur Viméo/Fondation de la Maison de la chimie.
Le quiz post-colloque est également en ligne. À vous de jouer !