

 |
Pourquoi se forme-t-il du tartre sur les résistances chauffantes ? Et peut-on l’éviter ?
|
Pourquoi se forme-t-il du tartre sur les résistances chauffantes ? Et peut-on l’éviter ?
Tout d’abord qu’est-ce que le tartre ? Tartre et calcaire sont synonymes et tous les deux constitués de carbonate de calcium de formule chimique CaCO3, c’est-à-dire formés à partir des ions calcium Ca2+ et des ions carbonates CO32-.
Le carbonate de calcium est très présent dans la nature, dans les terrains dit calcaires : Bassin parisien, Nord, Alpes, Jura, Champagne crayeuse..., comme le montre la figure 1.
L’eau qui pénètre dans ces sols dissout une partie des sels présents et s’enrichit ainsi en sels minéraux avant d’atteindre les nappes phréatiques d’où elle sera pompée puis traitée et rendue potable.
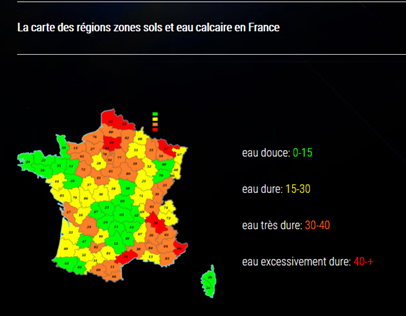
Figure 1 (i)
On définit la « dureté » de l'eau, paramètre qui mesure la quantité d’ions calcium et magnésium, présents dans l'eau. Elle s’exprime en degré TH (°f), pour Titre Hydrotimétrique français.
1 degré TH(°f ) = 4 mg de Ca2+ ou 2,4 mg de Mg2+ par litre d’eau.
On attribue les adjectifs « douce » ou « dure » aux eaux selon la valeur de ce TH.
Échelle (ii)
Notons que dans un terrain calcaire, l’eau s’est enrichie simultanément en ions calcium et carbonate.
Les ions carbonates participent à des équilibres acido-basiques, comme le montre la figure 2.
Le dioxyde de carbone CO2 est un acide faible et se transforme pour pH supérieur à 6,35 en ion hydrogénocarbonate (aussi appelé ion bicarbonate). Celui-ci se transforme en ion carbonate pour pH supérieur à 10,3.
L’eau du robinet a un pH compris entre 7,2 et 7,6. Il en est de même des eaux en bouteille non gazeuses. A ce pH, l’eau dure contient donc des ions calcium et des ions majoritairement sous forme d'hydrogénocarbonate et non de carbonate (cf. figure 2).

En réalité les trois espèces coexistent et sont toujours en équilibre dans l’eau, selon :
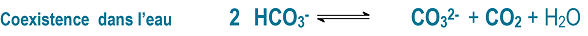
Dire que le bicarbonate est majoritaire c’est dire que les ions CO32- et le dioxyde de carbone CO2 sont très minoritaires mais présents.
Au final l’eau dure contient donc des ions calcium et des ions hydrogénocarbonates, qui restent dissous.
Le chauffage de l’eau va favoriser le dégazage de CO2 dont la solubilité dans l’eau diminue si la température augmente. Cela va provoquer naturellement un déplacement de l’équilibre précédent vers la droite pour reformer du CO2. Mais il se forme donc simultanément des ions carbonate. Or les ions carbonates et les ions calcium ont une affinité l’un pour l’autre et vont précipiter sous forme de carbonate de calcium. La réaction qui a lieu est la suivante :
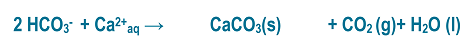
Le tartre s’est formé !
C’est la raison pour laquelle vous observez un dépôt de calcaire tout particulièrement sur les résistances de chauffe-eau, de lave-linge, de lave-vaisselle, dans les cafetières, dans les fers à repasser… Cela engendre des dépenses d’énergie supplémentaires, limite l’efficacité des savons et détergents, le linge est rêche…
Comme nous l’avons vu (figure 2), les ions carbonates sont des bases donc l’action d’un acide va détruire le calcaire. C’est le rôle des détartrants ou du vinaigre que vous pouvez utiliser. La réaction qui a lieu est
CaCO3 + 2 H+ → Ca2+ + CO2 (gaz) + H2O
Evidemment on ne peut pas mettre un détartrant directement au cours d’un cycle de lave-linge ou de lave-vaisselle. Dans ce cas on peut adoucir l’eau en remplaçant les ions calcium par les ions sodium, c’est le rôle du « sel régénérant », constitué de chlorure de sodium pur (NaCl). On peut aussi ajouter à la lessive un composé qui réagit sur les ions calcium (on parle de séquestration ou de complexation) les empêchant de précipiter avec les ions carbonates(iii).
Pour limiter l’entartrage des résistances de chauffe-eau, on peut adoucir l’eau en amont de l’installation.
Boire une eau dure ne pose aucun problème de santé. Bien au contraire : n’oublions pas que l’ion calcium a une grande importance physiologique (os, dents) et qu’il participe au fonctionnement de la cellule et à la contraction musculaire. L’ion magnésium participe à de très nombreux processus biologiques, au bon fonctionnement du système nerveux et son apport est exclusivement nutritionnel.
On prendra soin de ne pas boire l’eau adoucie riche en ions sodium, car une consommation en excès de ces ions peut entraîner de l'hypertension artérielle.
Françoise Brénon
(i) Source https://la-meilleure-centrale-vapeur.fr/le-calcaire/ [3]
(ii) Source https://fr.wikipedia.org/wiki/Duret%C3%A9_de_l%27eau [4]
(iii) ce sont souvent des tensioactifs anioniques de type carboxylate : RCOO- à longues chaine carbonée (R). Cela peut aussi être des hexamétaphosphates de sodium (Na6P6O18).
Crédit illustration : Résistance chauffe-eau, F. Brénon.
Liens:
[1] http://www.mediachimie.org/send-friend/4476/?ajax
[2] http://www.mediachimie.org/print/print/4476
[3] https://la-meilleure-centrale-vapeur.fr/le-calcaire/
[4] https://fr.wikipedia.org/wiki/Duret%C3%A9_de_l%27eau