


L’eau acheminée aux soldats du front était le lieu de prolifération de nombreux micro-organismes pathogènes sources de dysenteries et de la typhoïde. Et après les premières attaques aux gaz, l’état-major interdit formellement de boire l’eau qui se trouve sur le front car les gaz empoisonnent les eaux stagnantes.
Les méthodes ont évolué vers plus d’efficacité tout au long du conflit et diffèrent selon que l’on dispose d’eau en containers ou d’eau apportée directement et continûment par canalisation.
Pour l’eau fournie en containers le traitement se fait à l’iode avec 3 comprimés : 1 bleu, 1 blanc et 1 rouge. Patriote jusque dans le traitement de l’eau !
C’est en juillet 1902 que le pharmacien Auguste Georges et le médecin Villard [1] [2] décrivent une méthode d’épuration des eaux de boisson dans la revue de médecine et de pharmacie militaire. Les soldats disposent de 3 comprimés (i) :
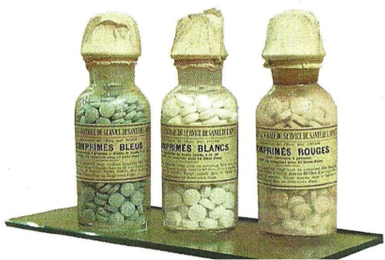

Comprimés tricolores (Musée du Service de Santé des Armées au Val-de-Grâce) source [2] ;
Tonnelet eau, Comprimés blancs et mode d'emploi (Photos F. Brénon au musée du Service de Santé des Armées au Val-de-Grâce)
Le mode d’emploi était le suivant : « Dissoudre 1 comprimé rouge avec 1 comprimé bleu dans ½ verre d’eau. Verser le liquide obtenu dans 10 L d’eau à traiter. Agiter. Attendre 10 min. Dissoudre 1 comprimé blanc dans un ½ verre d’eau. Verser cette solution dans les 10 L d’eau traités ».
Le comprimé bleu et le rouge dans l’eau engendraient du diiode, bactéricide et virulicide. Après avoir laissé agir, le comprimé blanc éliminait l’excès de diiode.
Plus en détail, les réactions mises en jeu et l’épuration étaient basées sur le principe suivant : le mélange d’iodure (I-) et d’iodate (IO3-) en présence d’acide (ici l’acide tannique) conduit à former du diiode (I2) dans le 1er récipient, selon la réaction :
IO3- + 5 I- + 6 H+ → 3 I2 + 3 H2O
Les proportions permettent de former une grande quantité de diiode.
L’agitation et le temps d’attente ont pour objet de faire réagir le diiode sur les microorganismes à éliminer.
Une fois l’action « d’épuration » par le diiode terminée, il faut éliminer l’excès de diiode restant. C’est le rôle du comprimé blanc qui permet de réaliser la réaction :
I2 + 2 S2O32- → S4O62- + 2 I-
Cette eau avait toutefois un gout iodé peu agréable.
Notons que le bleu de méthylène est à la fois un colorant et un bactéricide, l’acide tannique est un polyphénol de formule brute C76H52O46 et a aussi des propriétés astringentes et anti-diarrhéiques.
Les ions hypochlorite ClO- sont disponibles :
L’eau de Javel tire son nom du village de Javel à l’ouest de Paris où elle a été fabriquée de 1784 à 1889. Elle a été utilisée d’abord pour ses propriétés de blanchiment du linge découvertes par Claude-Louis Berthollet (1748-1822) et puis pour ses propriétés désinfectantes en solution diluée étudiées tout particulièrement par Antoine-Germain Labarraque (1777-1850). L’eau de Javel est efficace pour lutter contre la propagation des maladies telles que la typhoïde et le choléra propagées par de l’eau contaminée.
On a montré depuis que l’eau de Javel est à la fois bactéricide et virulicide, propriétés dues aux ions hypochlorite et l’acide hypochloreux [3] [4].
À partir de 1915 le médecin Vincent et le pharmacien C. Gaillard [2] mettent au point une formule de comprimés d’hypochlorite de calcium et de sodium pour purifier l’eau de boisson.
En 1916, le service de santé décide de la javellisation de l’eau, traitement antimicrobien utilisant de l’eau de Javel. Deux méthodes sont possibles :
En effet, lors de la bataille de Verdun, l'Armée française, encerclée, ne disposait plus d'eau potable. Le commandant du Génie Philippe Buneau-Varilla (iii), en 1916 à Verdun, réussit à capter et à acheminer l'eau de la Meuse au moyen de puits, de pompes et de tuyaux jusqu’aux tranchées. Il mit au point un procédé automatique de potabilisation de cette eau en faisant injecter de l’eau de javel diluée juste à l'entrée des pompes centrifuges. Ce procédé préconise des doses d’eau de Javel de dix à cinquante fois plus faibles que la javellisation (de l’ordre de 0,1 mg de chlore actif par litre). Cette eau avait un bien meilleur goût que celle ayant subi une javellisation.
La différence dans l’efficacité vient du protocole : dans ce procédé, l’addition de l’eau de Javel est réalisée lentement avec un brassage vigoureux et prolongé. Ces conditions favorisent la dissolution du dioxyde de carbone contenu dans l’air, ce qui abaisse le pH et favorise le passage de l’ion hypochlorite à la forme acide hypochloreux, HClO, qui est plus bactéricide (iv) [3].
Notes
(i) La composition des comprimés et le mode d’emploi sont indiqués sur les étiquettes des flacons présentées au musée du Service de santé des armées du Val de Grâce (Paris). Les réactions chimiques proposées par F. Brénon en découlent.
(ii) Que signifie l’expression eau de Javel ou chlorure de chaux « à Y grammes en chlore actif » ? L’eau de Javel comme le chlorure de chaux contiennent des ions chlorure, Cl-, et hypochlorite, ClO-, en mélange équimolaire. L’ajout d’un acide fait passer ClO- à l’état d’acide hypochloreux HClO. Et si le milieu devient très acide la réaction de HClO sur les ions Cl- provoque un dégagement de dichlore Cl2 selon la réaction :
(iii) Philippe Buneau-Varilla (1859–1940) était ingénieur polytechnicien. Le procédé de verdunisation qu’il a mis au point en 1916 a été utilisé par la suite dans une cinquantaine d’établissements publics industriels ou miniers et dans plus d’une centaine de villes.
(iv) Ph. Buneau-Varilla a également proposé une action des UV dans la purification de l’eau [6].
Bibliographie
[1] L’épuration de l’eau potable en campagne [4] - Archives de médecine et de pharmacie militaire (juillet 1902) p. 30 à 33 – BnF Gallica
[2] Histoire des comprimés pharmaceutiques en France, des origines au début du XXème siècle [5], André Frogerais (2013) p. 17 à 20. HAL : hal-00787009v4
[3] L'eau de Javel : sa chimie et son action biochimique [6], G. Durliat, J.L. Vignes et J.N. Joffin, BUP n° 792 (1997) p. 451 à 469 et tout particulièrement page 464 où est expliqué le rôle du pH et le pouvoir bactéricide de l’acide hypochloreux.
[4] Site internet de la FAO sur les rôles des composés chlorés et iodés : L’hygiène dans l’industrie agroalimentaire [7] . Dans cette ressource il faut toutefois corriger la réaction.
L'hypochlorite de sodium s'obtient suivant la réaction théorique suivante :2 NaOH + 2 Cl → NaOCl + NaCl + H2O
par 2 NaOH + Cl2 →NaOCl + NaCl + H2O
[5] Ph. Bunau-Varilla, Guide pratique et théorique de la Verdunisation, Paris, J-B. Baillière (1930)
[6] Quelques documents sur la verdunisation des eaux [8] , Ph. Buneau-Varilla, p. 40. BnF Gallica
[7] Bunau-Varilla et-la-verdunisation [9], article de La dépêche (1926)
Crédits illustrations
- Comprimés tricolores (Musée du Service de Santé des Armées au Val-de-Grâce) source [2] ;
- Tonnelet eau, Comprimés blancs et mode d'emploi (Photos F. Brénon au musée du Service de Santé des Armées au Val-de-Grâce)
- Couverture du livre Quelques documents sur la verdunisation des eaux, Ph. Buneau-Varilla, bibliothèque Exército Portugal
Liens:
[1] http://www.mediachimie.org/send-friend/4349/?ajax
[2] http://www.mediachimie.org/print/print/4349
[3] http://www.mediachimie.org/javascript%3Ahistory.go%28-1%29
[4] https://gallica.bnf.fr/ark:/12148/bd6t5385984z/f36.image.r=auguste%20georges?rk=21459;2
[5] https://hal.science/hal-00787009v4
[6] https://bupdoc.udppc.asso.fr/consultation/une_fiche.php?ID_fiche=6122
[7] http://www.fao.org/docrep/004/T0587F/T0587F04.htm
[8] https://gallica.bnf.fr/ark:/12148/bpt6k322213q/f54.item.r=Philippe%20Bunau-Varilla%20(1859-1940)
[9] https://www.ladepeche.fr/article/1999/01/17/273211-1926-bunau-varilla-et-la-verdunisation.html
[10] http://www.mediachimie.org/thematique/histoire-de-la-chimie
[11] http://www.mediachimie.org/liste-ressources/557
[12] http://www.mediachimie.org/liste-ressources/307
[13] http://www.mediachimie.org/liste-ressources/561